
题目列表(包括答案和解析)
(6分)在一定温度下的某容积可变的密闭容器中,建立下列化学平衡:
C(s)+H2O(g)CO(g)+H2(g)
试分析和回答下列问题:
(1)可认定上述可逆反应在一定条件下已达到化学平衡状态的是 (选填序号)。
A 体系的压强不再发生变化
B v正(CO)=v逆(H2O)
C 生成n molCO的同时生成n mol H2
D 1mol H-H键断裂的同时断裂2mol H-O键
(2)若上述化学平衡状态从正反应开始建立,达到平衡后,给平衡体系加压(缩小容积.其它条件不变。下同),则容器内气体的平均相对分子质量面将 (填写不变.变小.变大)。,达到平衡后,试讨论:
①容积内气体混合物的平均相对分子质量 的取值范围是 。
的取值范围是 。
②若给平衡体系加压,请参照起始投放的气体物质的平均相对分子质量(设定为 1),分别给出
1),分别给出![]() 的变化:(填“增大”.“减小”.“不变”)
的变化:(填“增大”.“减小”.“不变”)
|
|
|
|
|
|
|
| 不变 |
|
|
|
(6分)在一定温度下的某容积可变的密闭容器中,建立下列化学平衡:
C(s)+H2O(g) CO(g)+H2(g)
CO(g)+H2(g)
试分析和回答下列问题:
(1)可认定上述可逆反应在一定条件下已达到化学平衡状态的是 (选填序号)。
A 体系的压强不再发生变化
B v正(CO)=v逆(H2O)
C 生成n molCO的同时生成n mol H2
D 1mol H-H键断裂的同时断裂2mol H-O键
(2)若上述化学平衡状态从正反应开始建立,达到平衡后,给平衡体系加压(缩小容积.其它条件不变。下同),则容器内气体的平均相对分子质量面将 (填写不变.变小.变大)。[来源:学科
(3)若上述化学平衡状态从正.逆两反应同时建立[即起始时同时投放C(s).H2O(g).CO(g).H2(g)],达到平衡后,试讨论:
①容积内气体混合物的平均相对分子质量 的取值范围是
。
的取值范围是
。
②若给平衡体系加压,请参照起始投放的气体物质的平均相对分子质量(设定为 1),分别给出
1),分别给出 的变化:(填“增大”.“减小”.“不变”)
的变化:(填“增大”.“减小”.“不变”)
|
|
|
|
|
|
|
|
不变 |
|
|
|
在一定温度下的某容积可变的密闭容器中,建立下列化学平衡:
C(s)+H2O(g)![]() CO(g)+H2(g)
CO(g)+H2(g)
试分析和回答下列问题:
(1)可认定上述可逆反应在一定条件下已达到化学平衡状态的是 (选填序号)。
A 体系的压强不再发生变化
B v正(CO)=v逆(H2O)
C 生成n molCO的同时生成n mol H2
D 1mol H-H键断裂的同时断裂2mol H-O键
(2)若上述化学平衡状态从![]() 正反应开始建立,达到平衡后,给平衡体系加压(缩小容积.其它条件不变。下同),则容器内气体的平均相对分子质量面将 (填写不变.变小.变大)。,达到平衡后,试讨论:
正反应开始建立,达到平衡后,给平衡体系加压(缩小容积.其它条件不变。下同),则容器内气体的平均相对分子质量面将 (填写不变.变小.变大)。,达到平衡后,试讨论:
①容积内气体混合物的平均相对分子质量![]() 的取值范围是 。
的取值范围是 。
②若给平衡体系加压,请参照起始投放的气体物质的平均相对分子质量(设定为![]() 1),分别给出
1),分别给出![]() 的变化:(填“增大”.“减小”.“不变”)
的变化:(填“增大”.“减小”.“不变”)
|
|
|
|
| |
|
| 不变 |
|
|
煤化工中常需研究不同温度下平衡常数、投料比及热值等问题。
已知:CO(g)+H2O(g)  H2(g)+CO2(g)平衡常数随温度的变化如下表:
H2(g)+CO2(g)平衡常数随温度的变化如下表:
| 温度/℃ | 400 | 500 | 800 |
| 平衡常数K | 9.94 | 9 | 1 |
| | n(CO) | n(H2O) | n(H2) | n(CO2) |
| A | 1 | 5 | 2 | 3 |
| B | 2 | 2 | 1 | 1 |
| C | 3 | 3 | 0 | 0 |
| D | 0.5 | 2 | 1 | 1 |
| E | 3 | 1 | 2 | 1 |
 2CO(g)平衡常数K;K的表达式 ;
2CO(g)平衡常数K;K的表达式 ; CO(g)+H2(g) 平衡常数K1;
CO(g)+H2(g) 平衡常数K1; H2(g)+CO2(g)平衡常数K2;
H2(g)+CO2(g)平衡常数K2; 2CO(g)能判断该反应达到化学平衡状态的依据是________。
2CO(g)能判断该反应达到化学平衡状态的依据是________。 2CO(g),并维持反应过程中温度不变。已知甲容器中
2CO(g),并维持反应过程中温度不变。已知甲容器中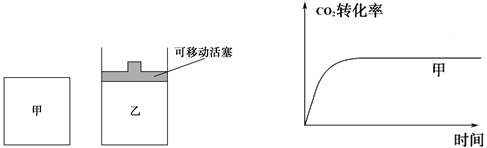
 (2011?福建模拟)一定条件下铁可以和CO2发生反应:
(2011?福建模拟)一定条件下铁可以和CO2发生反应: FeO(s)+CO(g);△H>0
FeO(s)+CO(g);△H>0湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com