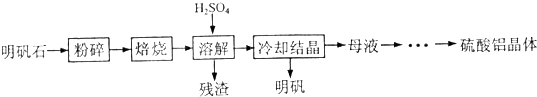
以明矾石[主要成分为K
2SO
4?Al
2(SO
4)
3?2Al
2O
3?6H
2O]为原料生产硫酸铝晶体[Al
2(SO
4)
3?18H
2O]和明矾[KAl(SO
4)
2?12H
2O]的实验流程如下:
两种不同形态的氧化铝的部分性质如下表:
| 物质 |
α-Al2O3 |
γ-Al2O3 |
| 性质 |
不溶于水和酸 |
不溶于水,溶于强酸或强碱,加热至1200℃可转化为α-Al2O3 |
Al
2(SO
4)
3、明矾在不同温度下的溶解度如下表:
温度/℃
溶解度/g |
0 |
20 |
40 |
60 |
80 |
100 |
| Al2(SO4)3 |
31.2 |
36.4 |
46.1 |
59.2 |
73.0 |
89.0 |
| 明矾 |
3.0 |
5.9 |
11.7 |
25 |
71 |
154 |
(1)①理论上得到硫酸铝晶体与明矾的物质的量之比为
.
②“焙烧”温度过高,会导致硫酸铝晶体产量降低,其原因是
.
(2)从“母液”制备硫酸铝晶体的实验步骤为:①
;②
;③过滤、洗涤、干燥.
(3)测定硫酸铝晶体样品中Al
2(SO
4)
3?18H
2O质量分数的实验步骤为(EDTA分别能与Al
3+或Pb
2+以物质的量之比1:1进行反应):
步骤1:准确称取硫酸铝晶体样品mg,溶于25mL水中.
步骤2:加入c
1 mol?L
-1EDTA溶液V
1mL(过量),煮沸、冷却,稀释至100mL.
步骤3:取25.00mL上述稀释液,滴加指示剂,用c
2 mol?L
-1 Pb(NO
3)
2标准溶液滴定过量的EDTA溶液,达到终点时消耗v
2mL Pb(NO
3)
2标准溶液.
①步骤2中“稀释至100mL”时,需要用到的玻璃仪器有烧杯、玻璃棒、量筒、
.
②根据上述数据计算,该样品中Al
2(SO
4)
3?18H
2O的质量分数为
(用含字母的代数式表示).
③若样品中含有可与EDTA反应的杂质离子,所测定的Al
2(SO
4)
3?18H
2O的质量分数将会
(填“偏高”、“偏低”或“不变”).

