
题目列表(包括答案和解析)
 (2013?绵阳模拟)A、B、D、E、G、M代表六种常见元素,它们的核电荷数依次增大.其中,元素M的基态3d轨道上有2个电子,A的基态原子L层电子数是K层电子数的2倍,E的 简单离子在同周期元素的简单离子中半径最小,D、G同主族;B与D形成的化合物有多种,其中一种是红棕色气体.
(2013?绵阳模拟)A、B、D、E、G、M代表六种常见元素,它们的核电荷数依次增大.其中,元素M的基态3d轨道上有2个电子,A的基态原子L层电子数是K层电子数的2倍,E的 简单离子在同周期元素的简单离子中半径最小,D、G同主族;B与D形成的化合物有多种,其中一种是红棕色气体.(8分)A、B、D、E是短周期中构成蛋白质的重要元素,其性质见下表。Fe、Co元素的常见化合价为+2、+3,能形成各种有色配离子。
|
|
A |
B |
D |
E |
|
化合价 |
-4 |
-2 |
-3 |
-2 |
|
电负性 |
2.5 |
2.5 |
3.0 |
3.5 |
(1)基态Fe原子的电子排布式为 。
(2)Fe、Co两元素的第三电离能I3(Fe) I3(Co)(填“<”或“>”)。
(3)B、D、E的气态氢化物的沸点由高到低的顺序为 (填化学式)。
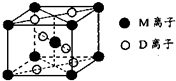
(4)Co与E形成的化合物晶胞如右图所示,则该化合物的化学式为 。(用元素符号表示)

(5)Co的离子能与AD-离子生成各种配合物。紫色的配离子[Co(AD)6]4- 是一种相当强的还原剂,在加热时能与水反应生成[Co(AD)6]3-。
①HAD分子中A元素的杂化类型为 ,D元素的化合价为 。
②写出[Co(AD)6]4-在加热时与水反应生成[Co(AD)6]3-的离子方程式: 。
| A | B | D | E | |
| 化合价 | -4 | -2 | -3 | -2 |
| 电负性 | 2.5 | 2.5 | 3.0 | 3.5 |
(8分)A、B、C、D、E代表5种元素。请填空:
(1)A元素基态原子的最外层有3个未成对电子,次外层有2个电子,其元素符号为 ;其氢化物的水溶液显 性。
(2)B元素的负二价离子和C元素的正二价离子的电子层结构都与氩相同,B的最高价氧化物的化学式为 ,C的元素符号为 ;
(3)D元素的正三价离子的3d亚层为半充满,D的元素符号为 ,其基态原子的电子排布式为 。
(4)E元素基态原子的M层全充满,N层没有成对电子,只有一个未成对电子,E的元素符号为 ,其基态原子的电子排布式为 。
(11分)
根据信息回答下列问题:
(1) 上表中实线是元素周期表的部分边界,请你用实线标出表的上边界,并把符合下列要求的元素的元素符号标在表中对应位置处。
① 最高价氧化物的水化物碱性最强(放射性元素除外)。
② 电负性最大。
③ 第一电离能对大。
(2)F元素的原子核外有25个运动状态不同的电子,F元素是 (名称),F2+的未成对电子数是_____ ,与F之具有相同最高正价的另一同周期元素的单质在常温下的状态为 。(填固态、液态、气态)
(3)列举一种由A、C、E、G四种元素组成的盐 。
(4)D的最高价氧化物对应的水化物属两性化合物,证明这一结论的有关离子方程式为_______________________________、_____________________________
(5)元素M基态原子中次外层有5个未成对电子而最外层只有一个电子; MCl3能与B和C的氢化物共同形成配位数为6的配合物,且两种配体的物质的量之比为2∶1,三个氯离子位于外界。MCl3形成的配合物的化学式为_____ ___(用具体元素符号表示)。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com