
题目列表(包括答案和解析)
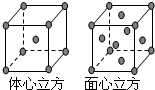 I:氮元素可以形成多种化合物.回答以下问题:
I:氮元素可以形成多种化合物.回答以下问题:A.Fe2+ B.Mg2+? C.CO![]() D.Ba2+
D.Ba2+
| |||||||||||||||||||||||||
|
恒温下,容积均为2 L的密闭容器M、N中,分别有以下列两种起始投料建立的可逆反应3A(g)+2B(g) 相关数据如下:容器M:3 mol A、2 mol B;2 min达平衡,生成D 1.2 mol,测得从反应开始到平衡C的速率为0.3 mol·(L·min)-1.容器N:2 mol C 、y mol D;达平衡时c(A)=0.6 mol·L-1.下列推断的结论中不正确的是 | |
| [ ] | |
A. |
x=2 |
B. |
平衡时M中c(A)<0.6 mol/L |
C. |
y≥0.8 |
D. |
平衡时M、N两容器中气体的平均相对分子质量相同 |
X元素的原子其核电荷数为n, 离子和
离子和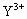 离子的电子层结构相同,则Y原子的质子数是
离子的电子层结构相同,则Y原子的质子数是
[ ]
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com