
题目列表(包括答案和解析)

| △ |
 ,若要合成
,若要合成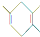 ,则下列所选原料正确的是
,则下列所选原料正确的是化学学科中的平衡理论主要包括:化学平衡、电离平衡、水解平衡和溶解平衡四种,且均符合勒夏特列原理.请回答下列问题:
有甲、乙两个容积相等的恒容密闭容器,
发生反应3A(g)+B(g)![]() xC(g) ΔH=Q KJ/mol
xC(g) ΔH=Q KJ/mol
回答下列问题:
(1)下列各项能作为判断该反应达到化学平衡状态的依据是________(填序号)
①化学反应速率:v(A)=3v(B)
②混合气体的密度保持不变
③有3 mol A消耗的同时有1 mol B生成
④C的浓度保持不变
(2)根据试验测得的数据可知,温度越高该反应的化学平衡常数越大,则Q________0(填“大于”或“小于”)
(3)向甲中通入6 mol A和2 mol B,向乙中通入1.5 mol A、0.5 mol B和3 mol C,将两容器的温度恒定在770 K,使反应3A(g)+B(g)![]() xc(g)达到平衡,此时测得甲、乙两容器中C的体积分数均为0.2.
xc(g)达到平衡,此时测得甲、乙两容器中C的体积分数均为0.2.
①若平衡时,甲、乙两容器中A的物质的量相等,则x=________;
②平衡时甲中A的体积分数为________;
③若平衡时两容器的压强不相等,则两容器中压强之比为________.
|
向甲、乙两个容积均为1 L的恒容容器中,分别充入2 mol A、2 mol B和1 mol A、1 mol B.相同温度下,发生反应:A(g)+B(g)
| |
A. |
x不可能等于2 |
B. |
甲、乙两容器中反应达平衡时,平衡常数K(甲)<K(乙) |
C. |
将乙容器升温可使甲、乙容器内各物质的体积分数相同 |
D. |
若向甲容器中再充入2 mol A、2 mol B,则平衡时甲容器中0.78 mol/L<c(A)<1.56 mol/L |
下图所示各物质是由1~20号元素中部分元素组成的单质或其化合物,图中部分反应条件未列出.已知C、H是无色有刺激性气味的气体,D是一种黄绿色的气体单质,物质J可用于饮水消毒.反应②和④是化工生产中的重要反应,反应⑤是实验室制备气体C的重要方法.
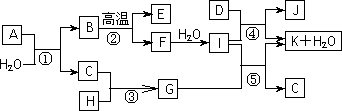
请回答下列问题:
(1)物质E的电子式是________;物质J的名称为________.
(2)反应⑤的化学方程式为__________________________________.
(3)反应③的现象为________________________________________.
(4)物质A由三种元素组成,1 mol A与水反应可生成1 mol B和2 mol C,A的化学式为________.
人们对酸碱的认识,已有几百年的历史,经历了一个由浅入深、由低级到高级的认识过程.目前中学课本中的酸碱理论是1889年阿仑尼乌斯(Arrhenius)提出的电离理论.
①1905年富兰克林(FranKlin)深入研究了水和液氨的相似性,把阿仑尼乌斯以水为溶剂的个别现象,推广到任何溶剂,提出了酸碱溶剂理论.溶剂理论认为:凡能电离而产生溶剂正离子的物质为酸,凡能电离而产生溶剂负离子的物质为碱.试写出液氨自身电离的方程式:________________.
②1923年丹麦化学家布朗斯特(Bronsted)和英国化学家劳莱(Lowey)提出质子理论.凡是能够释放质子(氢离子)任何含氢原子的分子或离子都是酸;凡是能够与质子(氢离子)结合的分子或离子都是碱.
按质子理论:下列粒子在水溶液既可以看作酸又可看碱的是________________.
A、H2O B、NH4+ C、OH- D、HCO3- E、CH3COO- F、Cl-
③1923年路易斯(Lewis)提出广义的酸碱概念.凡是能给出电子对而形成化学键的物质都是碱;凡是能够和电子对结合的物质都是酸.酸(电子对接受体)+碱(电子对给予体)→反应产物,如:H++OH-→H2O.试指出下列两个反应中的酸或碱:(Ⅰ)H3BO3+H2O![]() H++B(OH)4-,该反应中的碱是________(填H3BO3或H2O);(Ⅱ)NaH+H2O
H++B(OH)4-,该反应中的碱是________(填H3BO3或H2O);(Ⅱ)NaH+H2O![]() NaOH+H2↑,该反应中的酸是________(填NaH或H2O).
NaOH+H2↑,该反应中的酸是________(填NaH或H2O).
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com