
题目列表(包括答案和解析)
(12分)氨在国民经济中占有重要地位。
(1)合成氨工业中,合成塔中每产生2 mol NH3,放出92.2 kJ热量。
①工业合成氨的热化学方程式是_______。
②若起始时向容器内放入2 mol N2和6 mol H2,达平衡后放出的热量为Q,则Q(填“>”、“<”或“=”)_______184.4 kJ。
③已知:

1 mol N-H键断裂吸收的能量约等于_______kJ。
(2)工业生产尿素的原理是以NH3和CO2为原料合成尿素[CO(NH2)2],反应的化学方程式为2NH3 (g)+ CO2 (g)  CO(NH2)2 (l) + H2O
(l),该反应的平衡常数和温度关系如下:
CO(NH2)2 (l) + H2O
(l),该反应的平衡常数和温度关系如下:
|
T / ℃ |
165 |
175 |
185 |
195 |
|
K |
111.9 |
74.1 |
50.6 |
34.8 |
①焓变ΔH(填“>”、“<”或“=”)_______0。
②在一定温度和压强下,若原料气中的NH3和CO2的物质的量之比(氨碳比)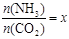 ,下图是氨碳比(x)与CO2平衡转化率(α)的关系。α随着x增大而增大的原因是_______。
,下图是氨碳比(x)与CO2平衡转化率(α)的关系。α随着x增大而增大的原因是_______。

③上图中的B点处,NH3的平衡转化率为_______。
(1)氯化铝水溶液呈 性(填“酸性”,“中性”或“碱性”),原因是(用离子方程式表示): 。把AlCl3溶液蒸干,灼烧,最后得到的主要固体产物是(写化学式) 。实验室在保存AlCl3溶液时,常在溶液中加少量的 ,以 (填“促进”、“抑制”)其水解。
(2)将等体积等物质的量浓度的醋酸和氢氧化钠溶液混合后,溶液呈 性(填“酸性”,“中性”或“碱性”),溶液中c(Na+) c(CH3COO-)(填“ >” 或“=”或“<”)。
(3)25℃时,pH=3的醋酸和pH=11的氢氧化钠溶液等体积混合后溶液呈 性,(填“酸性”,“中性”或“碱性”)溶液中c(Na+) c(CH3COO-) (填“ >” 或“=”或“<”)。
(4) 物质的量浓度相同的醋酸和氢氧化钠溶液混合后,溶液中醋酸根离子和钠离子浓度相等,则混合后溶液呈 性,(填“酸性”,“中性”或“碱性”),醋酸体积 氢氧化钠溶液体积(填“ >” 或“=”或“<”)。
(5)已知0.1 mol·L-1的NaHCO3溶液PH=9,则溶液中c(CO32-) c(OH-) (填“ >” 或“=”或“<”),其溶液显电中性的原因 (用离子浓度关系式表示)。
某二元酸(化学式用H2A表示)在水中的电离方程式是:
H2A==H++HA- HA- H++A2- 完成以下问题:
H++A2- 完成以下问题:
(1)Na2A溶液显______(填“酸性”“中性”或“碱性”),理由是________________(用离子方程式表示)。
(2)已知0.1 mol·L-1的NaHA溶液pH=2,则0.1 mol·L-1的H2A溶液中氢离子的物质的量浓度_______0.11 mol·L-1(填“>”“=”或“<”)。
(3)锅炉水垢中的CaSO4,可用Na2CO3溶液处理,转化为CaCO3,而后用酸除去。过程中发生:CaSO4(1)+
CO32- CaCO3(1)+ SO42-,已知298K时,Ksp[CaCO3]=2.80×10-9,Ksp[CaSO4]=4.90×10-5,求此温度下该反应的平衡常数K= (计算结果保留三位有效数字)
CaCO3(1)+ SO42-,已知298K时,Ksp[CaCO3]=2.80×10-9,Ksp[CaSO4]=4.90×10-5,求此温度下该反应的平衡常数K= (计算结果保留三位有效数字)
(每空3分,共9分)请写出下列反应的热化学方程式:
(1)25℃时,1 g甲烷气体完全燃烧生成二氧化碳气体和液态水,放出55.64kJ热量,写出该反应的热化学方程式: 。
(2)已知断裂1 mol H2(g)中的H—H键需要吸收436kJ的能量,断裂1 mol O2(g)中的共价键需要吸收498kJ的能量,生成H2O(g)中的1mol H—O键能放出463kJ的能量。试写出O2(g)与H2(g)反应生成H2O(g)的热化学方程式: 。
(3)已知:2H2S(g)+O2(g)=2S(s)+2H2O(l) △H=-a kJ·mol-1;
2H2S(g)+3O2(g)=2SO2(g)+2H2O(l) △H=-b kJ·mol-1。
则H2S与SO2两种气体转化为固体硫的热化学方程式为 。
氨在国民经济中占有重要地位。
(1)合成氨工业中,合成塔中每产生2 mol NH3,放出92.2 kJ热量。
① 工业合成氨的热化学方程式是 。
② 若起始时向容器内放入2 mol N2和6 mol H2,达平衡后放出的热量为Q,则
Q(填“>”、“<”或“=”)_______184.4 kJ。
③ 已知:

1 mol N-H键断裂吸收的能量约等于_______kJ。
(2)工业生产尿素的原理是以NH3和CO2为原料合成尿素[CO(NH2)2],反应的化学方程式为:2NH3 (g)+ CO2 (g)  CO(NH2)2
(l) + H2O (l),该反应的平衡常数和温度关系如下:
CO(NH2)2
(l) + H2O (l),该反应的平衡常数和温度关系如下:
|
T / ℃ |
165 |
175 |
185 |
195 |
|
K |
111.9 |
74.1 |
50.6 |
34.8 |
①焓变ΔH(填“>”、“<”或“=”) 0
②在一定温度和压强下,若原料气中的NH3和CO2的物质
的量之比(氨碳比) ,下图是氨碳比(x)与CO2平衡转化率(α)的关系。α随着x增大而增大的原因是
。
,下图是氨碳比(x)与CO2平衡转化率(α)的关系。α随着x增大而增大的原因是
。

③ 上图中的B点处,NH3的平衡转化率为_______。
(3)氮气是制备含氮化合物的一种重要物质,而氮的化合物用途广泛。
下面是利用氮气制备含氮化合物的一种途径:

①过程Ⅱ的化学方程式是
②运输时,严禁NH3与卤素(如Cl2)混装运输。若二者接触时剧烈反应产生白烟,并且0.4 mol NH3参加反应时有0.3 mol 电子转移。写出反应的化学方程式
③氨是一种潜在的清洁能源,可用作碱性燃料电池的燃料。
已知:4NH3(g) + 3O2(g) = 2N2(g) + 6H2O(g) ΔH = ―1316 kJ/mol,则该燃料电池的负极反应式是 。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com