
题目列表(包括答案和解析)
(1)逆:是指化学平衡研究的对象是_____________________。
(2)动:是指_________平衡,达到平衡状态时,正逆反应仍在不断进行,只是________________ _________________________而已。
(3)等:达到平衡状态时,_________________________相等,但不等于零。即v(正)=v(逆)≠0。
(4)定:平衡时,各组分的_____________保持一定,各组成成分的_____________保持一定。
(5)变:当外界条件(如浓度、压强、温度等)变化时,则原平衡被破坏,反应混合物中各组分的浓度就会发生变化,在新的条件下会重新建立平衡。
| 时间(min) | 0 | 10 | 20 | 30 | 40 | 50 | 60 | 70 |
| SO2 | 10 | 7 | 5 | 3.5 | 2 | 1 | 1 | 1 |
| O2 | 5 | 3.5 | 2.5 | 1.75 | 1 | 0.5 | 0.5 | 0.5 |
| SO3 | 0 | 3 | 5 | 6.5 | 8 | 9 | 9 | 9 |
| 压强/MPa 温度/℃ |
0.1 | 0.5 | 1 | 10 |
| 400 | 99.2% | 99.6% | 99.7% | 99.9% |
| 500 | 93.5% | 96.9% | 97.8% | 99.3% |
| 600 | 73.7% | 85.8% | 89.5% | 96.4% |
(1)若从下列四个地区选址新建一座硫酸厂,最合适的地点应在 附近。?
a.风景旅游区 b.硫酸消耗中心区? c.人口稠密区 d.黄铁矿矿区?
(2)工业生产硫酸的原料气成分(体积分数)为:SO27%,O211%,N2 82%。压强及温度对SO2转化率的影响如下:?
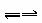
工业上,二氧化硫催化氧化过程采用的是常压而不是高压,主要原因是 。?
分析上表数据可知,二氧化硫的催化氧化是放热反应,理由是 。
(3)据测算,接触法制硫酸过程中,每生产1t 98%的硫酸需消耗3.60×105 kJ能量。若反应:2SO2(g)+O2(g)![]() 2SO3(g),ΔH =-196.6 kJ·mol-1放出的热量完全被利用,则每生产1t 98%的硫酸可为外界提供 kJ能量(不考虑其他过程释放的能量)。?
2SO3(g),ΔH =-196.6 kJ·mol-1放出的热量完全被利用,则每生产1t 98%的硫酸可为外界提供 kJ能量(不考虑其他过程释放的能量)。?
(4)依据题给数据计算:在500 ℃ 0.1 MPa条件下,二氧化硫的催化氧化达到平衡时,各种气体的体积比V(SO2)∶V(SO3)∶V(O2)∶V(N2)= ∶ ∶ ∶ (结果保留两位有效数字)。
向一定体积的密闭容器中加入2 mol A、0.6 mol C和一定量的B三种气体.一定条件下发生反应,各物质的量浓度随时间变化如图(Ⅰ)所示,其中t0~t1阶段c(B)未画出.图(Ⅱ)为t2时刻后改变反应条件,化学反应速率随时间变化的情况,四个阶段改变的条件均不相同,每个阶段只改变浓度、压强、温度、催化剂中的一个条件,其中t3~t4阶段为使用催化剂.

请回答下列问题:
(1)若t1=15 min,则t0~t1阶段以C物质的浓度变化表示的反应速率为________mol·L-1·min-1.
(2)t4~t5阶段改变的条件为________,B的起始物质的量浓度为________mol·L-1.
(3)t5~t6阶段保持容器内温度不变,若A的物质的量共变化了0.01 mol,而此过程中容器与外界的热交换总量为a kJ,写出此温度下该反应的热化学方程式________.
| |||||||||||||||
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com