
题目列表(包括答案和解析)
(1)将下列操作步骤补充完整:
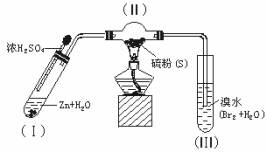
a._______________________________________________________________________
b.大火加热使硫沸腾与氢气化合.
c._______________________________________________________________________
d.停止加热并做善后处理.
(2)Ⅰ中制氢气不直接用稀硫酸与锌反应,而将浓硫酸滴入水中,其优点是____________.
(3)Ⅲ中发生的现象是_______________,由此得出的结论是_______________________.
我国高炉生产各方面取得了显著进步,但在资源和能源利用率、高炉大型化、提高产业集中度以及环保等方面还跟国际存在很大差距,有待进一步提高,努力向钢铁强国迈进。
(1)高炉炼铁的原料有铁矿、焦炭和石灰石,其中起熔剂作用的是 ,目的是除去铁矿石中的脉石,其产物密度比铁 ,所以在铁水的 (填“上部”或“下部”)形成炉渣而与铁水分离。
(2)焦炭在高炉炼铁中起着举足轻重的作用,下列不属于焦炭作用的是 。
A.作为燃料,为炼铁中的化学反应反应(删去)提供能量
B.作为还原剂与二氧化碳反应产生还原氧化铁的一氧化碳
C.对高炉中的物料起到支撑和疏散的作用
D.作为熔剂,除去铁矿石中的杂质
(3)高炉炼铁的污染非常严重,目前我国部分大城市中的钢铁厂借着搬迁的机会也在进行着工艺改进。高炉炼铁导致的环境污染有 。
(4)写出高炉炼铁中与碳元素有关的氧化还原反应化学方程式:
。
(1)为什么不用铜直接和浓硝酸反应?
(2)浓硝酸用等体积水稀释目的是什么?
(3)实际操作中使用过量的氧化铜中含有少量杂质铁,该反应要保温,以过热水蒸气加热,经过再结晶以制得纯净的硝酸铜,为什么要保温并通过热水蒸气?
(4)反应后尾气的污染应怎样处理?
工业上用铜和硝酸为原料制取硝酸铜生产中,先把铜屑在空气中灼烧生成氧化铜,再以等体积水稀释浓硝酸后与氧化铜反应得硝酸铜,试回答:
(1)为什么不用铜直接和浓硝酸反应?
(2)浓硝酸用等体积水稀释目的是什么?
(3)实际操作中使用过量的氧化铜中含有少量杂质铁,该反应要保温,以过热水蒸气加热,经过再结晶以制得纯净的硝酸铜,为什么要保温并通过热水蒸气?
(4)反应后尾气的污染应怎样处理?
| 温度/℃ | 10 | 20 | 30 |
| (NH4)2SO4 | 73.0 | 75.4 | 78.0 |
| FeSO4?7H2O | 20.0 | 26.5 | 32.9 |
| (NH4)2SO4?FeSO4 | 17.2 | 21.6 | 28.1 |

| 1 |
| V |
| 1 |
| V |
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com