
题目列表(包括答案和解析)
 在一定温度下,冰醋酸加水稀释过程中,溶液的导电能力I随加入水的体积V变化的曲线如图所示.请回答:
在一定温度下,冰醋酸加水稀释过程中,溶液的导电能力I随加入水的体积V变化的曲线如图所示.请回答:(8分)在一定温度下,冰醋酸加水稀释过程中溶液的导电能力如下图所示,请回答:
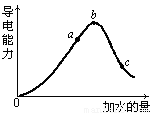
(1)写出醋酸的电离方程式_______________________________________。
(2)a、b、c三点溶液中氢离子浓度由小到大的顺序为________________ 。
(3)a、b、c三点中醋酸的电离程度最大的是 。
(4)取甲、乙两份等体积c点的溶液,甲用蒸馏水稀释10倍,,乙用蒸馏水稀释100倍,则稀释后甲、乙两溶液中的H+浓度:C(H+)甲__ 10C(H+)乙(填“大于”、“小于”或 “等于”)甲,其原因是: 。
(8分)在一定温度下,冰醋酸加水稀释过程中溶液的导电能力如下图所示,请回答:
(1)写出醋酸的电离方程式_______________________________________。
(2)a、b、c三点溶液中氢离子浓度由小到大的顺序为________________。
(3)a、b、c三点中醋酸的电离程度最大的是 。
(4)取甲、乙两份等体积c点的溶液,甲用蒸馏水稀释10倍,,乙用蒸馏水稀释100倍,则稀释后甲、乙两溶液中的H+浓度:C(H+)甲__10C(H+)乙(填“大于”、“小于”或 “等于”)甲,其原因是: 。
(8分)在一定温度下,冰醋酸加水稀释过程中溶液的导电能力如下图所示,请回答: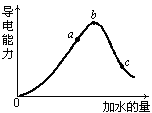
(1)写出醋酸的电离方程式_______________________________________。
(2)a、b、c三点溶液中氢离子浓度由小到大的顺序为________________ 。
(3)a、b、c三点中醋酸的电离程度最大的是 。
(4)取甲、乙两份等体积c点的溶液,甲用蒸馏水稀释10倍,,乙用蒸馏水稀释100倍,则稀释后甲、乙两溶液中的H+浓度:C(H+)甲__ 10C(H+)乙(填“大于”、“小于”或 “等于”)甲,其原因是: 。
| c(H+).c(Cl-).c(HClO) |
| C(Cl2) |
| 0.03×0.03×0.03 |
| 0.06 |
| c(H+).c(Cl-).c(HClO) |
| C(Cl2) |
| 0.03×0.03×0.03 |
| 0.06 |
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com