
题目列表(包括答案和解析)
某化学研究性学习小组探讨
Fe3+和SO32-之间发生怎样的反应,请你一起参与并协助他们完成实验.(1)提出猜想:
甲同学认为发生氧化还原反应,其反应的离子方程式为________;
乙同学认为发生双水解反应,其反应方程式为
2Fe3++3SO32-+6H2O=2Fe(OH)3(胶体)+3H2SO3;(2)实验验证:
丙同学设计了下列实验来探究反应的可能性.
①为了检验所用Na2SO3是否变质,应选用的试剂是________.
②取5 mL FeCl3溶液于试管中,逐滴加入Na2SO3溶液至过量,观察到溶液颜色由黄色变为红棕色(无气泡产生,也无沉淀生成).
③将②溶液分成两等份,其中一份加入稀盐酸至过量,再加入BaCl2稀溶液,有白色沉淀生成;另一份滴入几滴KSCN溶液,溶液变成血红色.
(3)得出结论:
①根据丙同学的实验得出的结论是:________;
②实验③中溶液变成血红色的离子方程式为________.
(4)拓展探究:
①丁同学在FeCl3溶液中加入Na2CO3溶液,观察到红褐色沉淀并且产生无色气体,该反应的离子方程式是________.
②从形式上看,Na2CO3和Na2SO3相似,但是从上述实验中可以看到,二者的水溶液与氯化铁溶液反应的现象差别很大,其可能的原因除SO32-水解能力较CO32-________(填“大”或“小”)外,还有________.
某化学研究性学习小组讨论Fe3+和SO32-之间发生怎样的反应,提出了两种可能:一是发生氧化还原反应:2Fe3++SO32-+H2O=2Fe2++SO42-+2H+;二是发生双水解反应:2Fe3++3SO32-+6H2O=2Fe(OH)3(胶体)+3H2SO3。为了证明是哪一种反应发生,同学们设计并实施了下列实验,请填写下列空白:
实验Ⅰ,学生选择的实验用品:Na2SO3浓溶液、BaCl2稀溶液、稀盐酸;试管若干、胶头滴管若干。从选择的药品分析,作者设计这个实验的目的是________。
实验Ⅱ,取5mLFeCl3浓溶液于试管中,逐滴加入Na2SO3浓溶液,观察到溶液颜色由黄色变为红棕色,无气泡产生,无沉淀生成,继续加入Na2SO3浓溶液至过量,溶液颜色加深,最终变为红褐色。这种红褐色液体是________。向红褐色液体中逐滴加入稀盐酸至过量,可以观察到的现象是________。将溶液分成两等份,其中一份加入KSCN溶液,溶液变成血红色,反应的离子方程式为+________。另一份加入BaCl2稀溶液,有少量白色沉淀生成,产生该白色沉淀的离子方程式是________。
实验Ⅲ,换用稀释的FeCl3和Na2SO3溶液重复实验Ⅱ、Ⅲ,产生的现象完全相同。由上述实验得出的结论是________。若在FeCl3浓溶液中加入Na2CO3浓溶液,观察到红褐色沉淀并且产生无色气体,该反应的化学方程式是________。
从形式上看,Na2CO3和Na2SO3相似,但是从上述实验中可以看到,二者的水溶液与氯化铁溶液反应的现象差别很大,分析其原因可能是:
①________;②________。
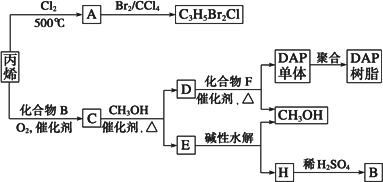
丙烯可用于合成杀除根瘤线虫的农药(分子式为C3H5Br2Cl)和应用广泛的DAP树脂,流程如下图所示:
已知酯与醇可发生如下酯交换反应:
RCOO![]() +
+![]() OHRCOO
OHRCOO![]() +
+![]() OH(R,
OH(R,![]() ,
,![]() 代表烃基)
代表烃基)
(1)农药分子C3H5Br2Cl中每个碳原子上均连有卤原子.
①A的结构简式是________;
A含有的官能团名称是________;
②由丙烯生成A的反应类型是________.
(2)A水解可得到D,该水解反应的化学方程式是________.
(3)C蒸气密度是相同状态下甲烷密度的6.25倍,C中各元素的质量分数分别为:碳60%,氢8%,氧32%.C的结构简式是________.
(4)下列说法正确的是(选填序号字母)________.
a.C能发生聚合反应、还原反应和氧化反应
b.C含有两个甲基的羧酸类同分异构体有4个
c.D催化加氢的产物与B具有相同的相对分子质量
d.E有芳香气味,易溶于乙醇
(5)E的水解产物经分离最终得到甲醇和B,二者均可循环用于DAP树脂的制备.其中将甲醇与H分离的操作方法是________.
(6)F的分子式为C10H10O4.DAP单体为苯的二元取代物,且两个取代基不处于对位,该单体苯环上的一溴取代物只有两种.D和F反应生成DAP单体的化学方程式是________.
多晶硅(硅单质的一种)被称为“微电子大厦的基石”,制备中副产物以SiCl4为主,它对环境污染很大,能遇水强烈水解,放出大量的热.研究人员利用SiCl4水解生成的盐酸和钡矿粉(主要成份为BaCO3,且含有铁、镁等离子)制备BaCl2·2H2O,工艺流程如下.已知:①常温下Fe3+、Mg2+完全沉淀的pH分别是:3.4、12.4.
②M(BaCO3)=197 g/mol,M(BaCl2·2H2O)=244 g/mol
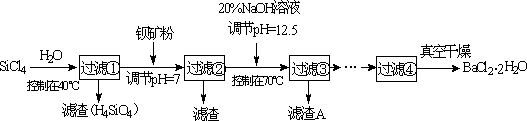
(1)SiCl4水解反应的方程式为________.
已知:SiCl4(s)+H2(g) SiHCl3(s)+HCl(g) ΔH1=+47 kJ/mol
SiHCl3(s)+HCl(g) ΔH1=+47 kJ/mol
SiHCl3(s)+H2(g) Si(s)+3HCl(g) ΔH2=+189 kJ/mol
Si(s)+3HCl(g) ΔH2=+189 kJ/mol
则由SiCl4制备硅的热化学方程式为________.
(2)加钡矿粉并调节pH=7的作用是使BaCO3转化为BaCl2和________.
(3)加20% NaOH调节pH=12.5,得到滤渣A的主要成分是________.
(4)BaCl2滤液经________、________、过滤、洗涤,再经真空干燥后得到BaCl2·2H2O.
(5)10吨含78.8% BaCO3的钡矿粉理论上最多能生成BaCl2·2H2O________吨.
已知反应X+Y= M+N为放热反应,,对该反应的下列说法中正确的 ( )
A、X的能量一定高于M
B、Y的能量一定高于N
C、X和Y的总能量一定高于M和N的总能量
D、因该反应为放热反应,故不必加热就可发生
【解析】考查放热反应和吸热反应的有关概念和判断。在反应中若反应物的总能量低于生成物的总能量,则是吸热反应,反之是放热反应。反应是放热反应还是吸热反应与反应条件无关,所以正确的答案是C。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com