
题目列表(包括答案和解析)
将15.68 L(标准状况)的氯气通入70℃.500 mL氢氧化钠溶液中,发生了两个自身氧化还原反应,其氧化产物为次氯酸钠和氯酸钠.若取此溶液25 mL,稀释到250 mL,再取稀释后的溶液25 mL用醋酸酸化后,加入过量碘化钾溶液充分反应,此时只有次氯酸钠氧化碘化钾.用浓度为0.20 mol/L硫代硫酸钠(Na2S2O3)测定析出的碘:I2+2Na2S2O3![]() 2NaI+Na2S4O6,需用硫代硫酸钠溶液5.0 mL.将上述测定后的溶液再用盐酸调至强酸性,此时氯酸钠亦能氧化碘化钾,析出的碘再用上述硫代硫酸钠测定,又用了30.0 mL.
2NaI+Na2S4O6,需用硫代硫酸钠溶液5.0 mL.将上述测定后的溶液再用盐酸调至强酸性,此时氯酸钠亦能氧化碘化钾,析出的碘再用上述硫代硫酸钠测定,又用了30.0 mL.
(1)计算反应后溶液中次氯酸钠和氯酸钠的物质的量之比.
(2)用一个总化学方程式表示题中氯气通入70℃氢氧化钠溶液中所发生的化学反应.
(3)假设题中氢氧化钠溶液的体积在通入氯气前后的变化可忽略不计,请计算通入氯气后各生成物的物质的量浓度.
A、B、C、X是中学化学常见物质,均由短周期元素组成,转化关系如图.请针对以下三种不同情况回答:
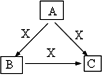
(1)若A、B、C中均含同一种常见金属元素,该元素在C中以阴离子形式存在.则,A中含有的金属元素的名称为________.
(2)若A为固态非金属单质,A与X同周期,常温常压下C为白色固体,B分子中各原子最外层均为8电子结构.
①B的电子式为________.
②C与水剧烈反应,生成两种常见酸,反应的化学方程式为:_______________.
(3)若A、B、C的焰色反应均呈黄色,水溶液均为碱性.
①A中所含有的化学键是________、________.
②将4.48 L(标准状况下)X通入100 mL 3 mol/L A的水溶液后,溶液中离子浓度由大到小的顺序为________.
A、B、C、X是中学化学常见物质,均由短周期元素组成,转化关系如图所示.请针对以下三种不同情况回答:
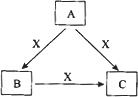
(1)若A、B、C中均含同一种常见金属元素,该元素在C中以阴离子形式存在,将A、C的水溶液混合可得B的白色胶状沉淀
①A中含有的金属元素为________.
②该金属元素的单质与某氧化物在高温下反应,可用于焊接铁轨及定向爆破,反应的化学反应方程式为________.
(2)若A为固态非金属单质,A与X同周期,常温常压下C为白色固体,B分子中各原子最外层均为8电子结构.
①B的电子式为________.
②C与水剧烈反应,生成两种常见酸,反应的化学方程式为________.
(3)若A、B、C的焰色反应均呈黄色,水溶液均为碱性.
①A中所含有的化学键是________.
②将4.48 L(标准状况下)X通入100 mL 3 mol/L A的水溶液后,溶液中离子浓度由大到小的顺序为________.
③自然界中存在B、C和H2O按一定比例结晶而成的固体.取一定量该固体溶于水配成100 mL溶液,测得溶溶中金属阳离子的浓度为0.5 mol/L.若取相同质量的固体加热至恒重,剩余固体的质量为________.
 (1)把AlCl3溶液蒸干,灼烧,最后得到的主要固体产物是
(1)把AlCl3溶液蒸干,灼烧,最后得到的主要固体产物是湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com