
题目列表(包括答案和解析)
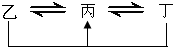 元素A、B、C、D、E、F是位于元素周期表前四周期元素,且原子序数依次增大.其中 D、F为常见金属元素;A元素原子核内只有一个质子,元素A与B形成的气态化合物甲在标准状况下的密度为0.759g?L-1,C元素原子的最外层电子数是其电子层数的3倍,E与C同主族,由D或F元素组成的单质或某些离子(或化合物)在溶液中均有下列转化关系(其它参与反应的物质未列出):其中,均含D元素的乙、丙、丁微粒间的转化全为非氧化还原反应;均含F元素的乙、丙、丁微粒间的转化全为氧化还原反应;相邻的乙与丙或丙与丁两两间均互不发生化学反应.请回答下列问题:
元素A、B、C、D、E、F是位于元素周期表前四周期元素,且原子序数依次增大.其中 D、F为常见金属元素;A元素原子核内只有一个质子,元素A与B形成的气态化合物甲在标准状况下的密度为0.759g?L-1,C元素原子的最外层电子数是其电子层数的3倍,E与C同主族,由D或F元素组成的单质或某些离子(或化合物)在溶液中均有下列转化关系(其它参与反应的物质未列出):其中,均含D元素的乙、丙、丁微粒间的转化全为非氧化还原反应;均含F元素的乙、丙、丁微粒间的转化全为氧化还原反应;相邻的乙与丙或丙与丁两两间均互不发生化学反应.请回答下列问题:

(9分)元素A~D是元素周期表中短周期的四种元素,请根据表中信息回答下列问题。
(1)上表中与A属于同一周期的元素是 (填元素名称),写出D离子结构示意图 。
(2)D和B形成的化合物的化学式为 。
写出A单质与水反应的离子方程式 。
(3)对B、C的单质或化合物描述正确的是 。
a.C元素的最高正价为+7 b.常温、常压下C单质性质稳定
c.B的氧化物只有两种 d.C单质分子中含有18个电子
(4)从海水中提取D的单质可按如下步骤进行:①把贝壳制成石灰乳;②向引入的海水中加入石灰乳,沉降、洗涤、过滤沉淀物;③将沉淀物与盐酸反应,结晶、过滤、干燥;④电解得到产物。以上提取D的单质的过程中,没有涉及的化学反应类型是
a.分解反应 b.化合反应 c.复分解反应 d.置换反应
(10分)元素氯及其化合物在生产、生活、科研中有广泛的应用。
⑴25℃时,PbCl2固体在不同浓度盐酸(mol·L-1)中的
溶解度(mmol·L-1)如右图。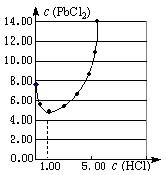
①在制备PbCl2的实验中,洗涤PbCl2固体最好选用 。
a.蒸馏水 b.1mol·L-1盐酸
c.5 mol·L-1盐酸 d.10mol·L-1盐酸
②当盐酸的浓度小于1mol·L-1时,随着盐酸浓度的增大, PbCl2的溶解度减小,其原因是 。
⑵TCCA广泛用于漂白、杀菌消毒,其学名为三氯均三嗪-2,4,6-三酮,分子式为C3Cl3N3O3。
①TCCA分子具有完全对称的结构,并含有一个六元环,则其结构简式为 。
②使用TCCA时,需先将该物质溶解于水,其水解产物之一为C3H3N3O3,另一种产物具有强氧化性,能够杀菌消毒。写出另一种产物的电子式 。
⑶高氯酸铵(AP)作为一种优良的固体推进剂被用于导弹和火箭发射。目前,较为先进的制备方法是电解高纯次氯酸得到高纯高氯酸,再与高纯氨进行喷雾反应制成高氯酸铵。写出由次氯酸电解制备高氯酸的阳极反应式: 。
(10分)元素氯及其化合物在生产、生活、科研中有广泛的应用。
⑴25℃时,PbCl2固体在不同浓度盐酸(mol·L-1)中的溶解度(mmol·L-1)如图。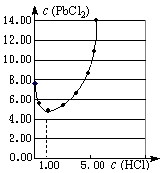
①在制备PbCl2的实验中,洗涤PbCl2固体最好选用 。
a.蒸馏水 b.1mol·L-1盐酸
c.5 mol·L-1盐酸 d.10mol·L-1盐酸
②当盐酸的浓度小于1mol·L-1时,随着盐酸浓度的增大,PbCl2 的溶解度减小,其原因是 。
⑵TCCA广泛用于漂白、杀菌消毒,其学名为三氯均三嗪-2,4,6-三酮,分子式为:C3Cl3N3O3。
①TCCA分子具有完全对称的结构,并含有一个六元环,则其结构简式为 。
②使用TCCA时,需先将该物质溶解于水,其水解产物之一为C3H3N3O3,另一种产
物具有强氧化性,能够杀菌消毒。写出另一种产物的电子式 。
⑶高氯酸铵(AP)作为一种优良的固体推进剂被用于导弹和火箭发射。目前,较为先进的制备方法是电解高纯次氯酸得到高纯高氯酸,再与高纯氨进行喷雾反应制成高氯酸铵。写出由次氯酸电解制备高氯酸的阳极反应式: 。
(9分)元素A~D是元素周期表中短周期的四种元素,请根据表中信息回答下列问题。
(1)上表中与A属于同一周期的元素是 (填元素名称),写出D离子结构示意图 。
(2)D和B形成的化合物的化学式为 。
写出A单质与水反应的离子方程式 。
(3)对B、C的单质或化合物描述正确的是 。
a.C元素的最高正价为+7 b.常温、常压下C单质性质稳定
c.B的氧化物只有两种 d.C单质分子中含有18个电子
(4)从海水中提取D的单质可按如下步骤进行:①把贝壳制成石灰乳;②向引入的海水中加入石灰乳,沉降、洗涤、过滤沉淀物;③将沉淀物与盐酸反应,结晶、过滤、干燥;④电解得到产物。以上提取D的单质的过程中,没有涉及的化学反应类型是
a.分解反应 b.化合反应 c.复分解反应 d.置换反应
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com