
题目列表(包括答案和解析)
 实验化学
实验化学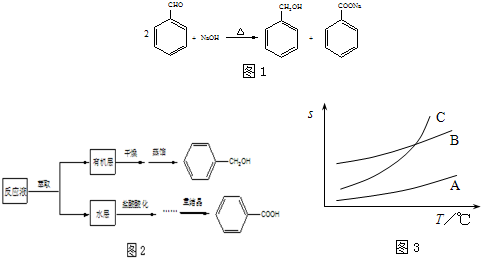
已知:苯甲酸在水中的溶解度为:0.18g(4℃)、0.34g(25℃)、6.8g(95℃)。乙醚的沸点为34.6℃。实验室常用苯甲醛制备苯甲醇和苯甲酸,其原理为:2C6H5―CHO+NaOH C6H5―CH2OH+C6H5―COONa
C6H5―CH2OH+C6H5―COONa
实验步骤如下:
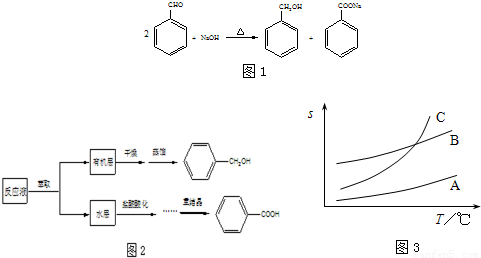
①向如图所示装置中加入适量 NaOH、水和苯甲醛,混匀、加热,使反应充分进行。

②从冷凝管下口加入冷水,混匀,冷却。倒入分液漏斗,用乙醚萃取、分液。水层保留待用。将乙醚层依次用10%碳酸钠溶液、水洗涤。
③将乙醚层倒入盛有少量无水硫酸镁的干燥锥形瓶中,混匀、静置后将其转入蒸馏装置,缓慢均匀加热除去乙醚,收集198℃~204℃馏分得苯甲醇。
④将步骤②中的水层和适量浓盐酸混合均匀,析出白色固体。冷却、抽滤得粗产品,将粗产品提纯得苯甲酸。
(1)步骤②中,最后用水洗涤的作用是 。将分液漏斗中两层液体分离开的实验操作方法是:先 后 。
(2)步骤③中无水硫酸镁的作用是 。
(3)步骤④中水层和浓盐酸混合后发生反应的化学方程式为 ;将反应后混合物冷却的目的是 。
(4)抽滤装置所包含的仪器除减压系统外,还有 、 (填仪器名称)。
已知:苯甲酸在水中的溶解度为:0.18g(4℃)、0.34g(25℃)、6.8g(95℃)。乙醚的沸点为34.6℃。实验室常用苯甲醛制备苯甲醇和苯甲酸,其原理为:2C6H5―CHO+NaOH C6H5―CH2OH+C6H5―COONa
C6H5―CH2OH+C6H5―COONa
实验步骤如下:
①向如图所示装置中加入适量 NaOH、水和苯甲醛,混匀、加热,使反应充分进行。
②从冷凝管下口加入冷水,混匀,冷却。倒入分液漏斗,用乙醚萃取、分液。水层保留待用。将乙醚层依次用10%碳酸钠溶液、水洗涤。
③将乙醚层倒入盛有少量无水硫酸镁的干燥锥形瓶中,混匀、静置后将其转入蒸馏装置,缓慢均匀加热除去乙醚,收集198℃~204℃馏分得苯甲醇。
④将步骤②中的水层和适量浓盐酸混合均匀,析出白色固体。冷却、抽滤得粗产品,将粗产品提纯得苯甲酸。
(1)步骤②中,最后用水洗涤的作用是 。将分液漏斗中两层液体分离开的实验操作方法是:先 后 。
(2)步骤③中无水硫酸镁的作用是 。
(3)步骤④中水层和浓盐酸混合后发生反应的化学方程式为 ;将反应后混合物冷却的目的是 。
(4)抽滤装置所包含的仪器除减压系统外,还有 、 (填仪器名称)。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com