
题目列表(包括答案和解析)
 铁和铁的化合物在工业生产和日常生活中都有广泛的用途.请回答下列问题:
铁和铁的化合物在工业生产和日常生活中都有广泛的用途.请回答下列问题:
| ||
| 充电 |
 Fe(OH)2+Ni(OH)2;高铁酸酸钠(Na2FeO4)是一种新型净水剂.用下面装置可以制取少量高铁酸钠.
Fe(OH)2+Ni(OH)2;高铁酸酸钠(Na2FeO4)是一种新型净水剂.用下面装置可以制取少量高铁酸钠.
| ||
| ||
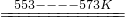 SiHCl3(l)+H2(g)
SiHCl3(l)+H2(g)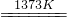 Si(纯)+3HCl
Si(纯)+3HCl
一、选择题(1~9小题,每小题3分;10~18小题最多两个答案,每小题4分,答对一个得2分,答对两个得4分,但只要答错一个得0分,共63分)
题号
1
2
3
4
5
6
7
8
9
答案
C
C
A
B
A
C
D
D
A
题号
10
11
12
13
14
15
16
17
18
答案
AC
B
BC
AD
B
AD
C
C
C
三、(共33分)
 19.(9分)Ⅰ.Cu2+ + 2H2O Cu(OH)2 + 2H+
,加入金属锌,与H+反应,降低H+浓度,使平衡向正方向移动,生成Cu(OH)2沉淀 (2分)
19.(9分)Ⅰ.Cu2+ + 2H2O Cu(OH)2 + 2H+
,加入金属锌,与H+反应,降低H+浓度,使平衡向正方向移动,生成Cu(OH)2沉淀 (2分)
Ⅱ.(3)(操作2分,预期现象与结论各1分,共5分)
实验操作
预期现象与结论
(a)将粉末放入试管中,加入足量
3 mol?L-1H2SO4,充分震荡
(b)过滤向红色固体中加入浓硝酸
有气体产生 含有Zn
溶液呈蓝色 含有CuO
溶液呈蓝色并有红棕色气体放出 含有Cu
(4)往CuSO4溶液中加入适量稀硫酸是溶液呈酸性,抑制Cu2+水解 (2分)
20、(13分)(1)AlO2- + H+ + H2O = Al(OH)3↓ 或 Al(OH)4- + H+ = Al(OH)3↓ + H2O (2分,没有↓符号扣1分,其他任何错误0分)
用洁净的玻璃棒沾取溶液滴到pH试纸上,待变色后,与比色卡对照,读出pH值。(2分)
(2)加热浓缩 冷却结晶 过滤 (各1分,共3分)
(3)减少产品的损失(或“减少晶体的溶解”或“明矾在酒精中的溶解度小”等)(1分)
往漏斗中加入洗涤剂至浸没固体,自然流出,重复2~3次 (2分)
(4)不可行 (1分)因为按此方法获得的溶液中还含有Mg2+,最后得到的产品不纯(2分)
21、(11分)(1)本问题有几种正确方案:
B、F、E、B 浓硫酸;或者,B、F、E、B NaOH溶液;或者E、F、E、B NaOH溶液
(连接2分,A中物质2分,共4分)
(2)碱石灰 防止空气中的水蒸气和CO2进入B中 偏小 (各1分,共3分)
(3)乙醇 CuSO4(或无水硫酸铜) (各1分,共2分)
(4)将试管D加热至沸,出现砖红色(或红色)沉淀 (2分)
四、(本题包括3小题,共34分)22、(14分)答案及评分标准:
Ⅰ: (每空2分,方程式错一处均不给分)
(1)CO32-+H2O HCO3-+OH-或 HCO3-+H2O
HCO3-+OH-或 HCO3-+H2O H2CO3 +OH-
H2CO3 +OH-
(2)2H2SO3+O2=4H++2SO42-或2HSO3-+O2=2H++2SO42- (任写一个化学方程式或离子方程式均给分) 中和、稀释经氧气氧化后海水中生成的酸(H+)
Ⅱ:(3)B(2分) (4)1.2×10-3 mol?L-1(2分)
(5)处理后的废水中Cl-的物质的量浓度为:
C(Cl-)=  (2分)
(2分)
当反应达到AgCl的沉淀溶解平衡后,由Ksp(AgCl)=[Ag+]?[Cl-]可
[Ag+]=
答:Ag+符合排放标准。(2分)
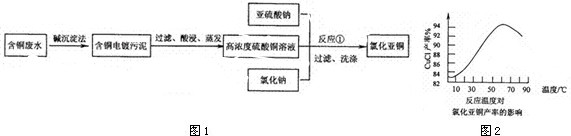
23、(10分)答案及评分标准:(每空2分,方程式错一处均不给分)
⑴ 清洗废铁屑表面的油污; (2)2Fe2+ + H2O2 + 2H+ ==2Fe3+ + 2H2O
(3)10NaOH + 3Cl2 + 2Fe(OH)3 == 2Na2FeO4 + 6NaCl + 8H2O
(4)高铁酸盐在杀菌消毒时,本身被还原成Fe3+,Fe3+易水解生成Fe(OH)3,具有胶体的性质,可吸附水中的悬浮杂质,而起到净化水的作用。(只答出Fe3+易水解生成Fe(OH)3,给1分) (5)Fe-6e-+8OH-=FeO42-+4H2O
24、(10分)(1)50%(2分)(2)K3=1.50(2分)(3)△H<0(2分)(4)B (2分) (5)a(2分)
五、25题:(10分)(有机化学方程式没有注明条件扣1分,配平和书写错误0分)
答案:(1)AD (2分) (2) 利用二氯乙烷热裂解所产生的氯化氢作为氯化剂,从而使氯得到完全利用,不向环境排放毒害气体。(2分)

(3) (2分)

(4) (2分)

|