
题目列表(包括答案和解析)
 现有A、B、C、D四种元素,其原子序数依次递增.已知,A、C为短周期非金属元素,其单质在常温下均为气体,两单质混合见光爆炸生成AC,AC溶液显强酸性.B、D为金属元素,B的原子序数为D的一半,D与C2和AC溶液反应分别得DC3和DC2,烧碱溶液不能与D单质反应,而能与B单质反应.请回答下列问题:
现有A、B、C、D四种元素,其原子序数依次递增.已知,A、C为短周期非金属元素,其单质在常温下均为气体,两单质混合见光爆炸生成AC,AC溶液显强酸性.B、D为金属元素,B的原子序数为D的一半,D与C2和AC溶液反应分别得DC3和DC2,烧碱溶液不能与D单质反应,而能与B单质反应.请回答下列问题:
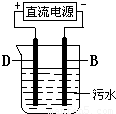
 (2009?湖北模拟)现有A、B、C、D四种元素,其原子序数依次递增.已知,A、C为短周期非金属元素,其单质在常温下均为气体,两单质混合见光爆炸生成AC,AC溶液显强酸性.B、D为金属元素,B的原子序数为D的一半,D与C2和AC溶液反应分别得DC3和DC2,烧碱溶液不能与D单质反应,而能与B单质反应.请回答下列问题:
(2009?湖北模拟)现有A、B、C、D四种元素,其原子序数依次递增.已知,A、C为短周期非金属元素,其单质在常温下均为气体,两单质混合见光爆炸生成AC,AC溶液显强酸性.B、D为金属元素,B的原子序数为D的一半,D与C2和AC溶液反应分别得DC3和DC2,烧碱溶液不能与D单质反应,而能与B单质反应.请回答下列问题:



(10分)现有A、B、C、D四种短周期主族元素,其中原子序数依次增大。已知B和D同主族。A元素的最高正价和最低负价的绝对值之差为2;1molC单质能与冷水反应,在标准状况下生成11.2LH2;D-的电子层结构与Ar原子相同。请回答下列问题:
⑴在右图塔式周期表相应位置标出A、B、C、D 四种元素的元素符号。同时在图中将过渡元素涂黑。
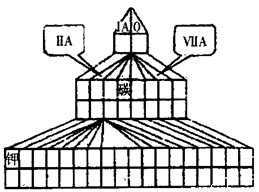
⑵用电子式表示B与C形成化合物的过程___________。
⑶图中“钾”和D形成的简单离子的半径大小为________________(用离子符号和“>”、“=”或“<”表示)。
⑷元素非金属性强弱比较有很多方法,其中A和D的非金属性强弱的研究方案中比较可行的是_________(填序号)。
①比较两种单质的颜色 ②比较氢化物的稳定性
③比较原子半径大小 ④比较最高价氧化物对应水化物的酸性
⑸A元素能与另外三种元素中的一种元素形成共价化合物,分子中的原子个数比为1:3,相对分子质量为120.5。则该物质的结构式为____________。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com