
题目列表(包括答案和解析)
在一定条件下,单质B、C、D、E都能与A单质发生化合反应,转化关系如图所示。已知:①G是黑色晶体,能吸附B单质;②H能与氢氧化钠溶液或盐酸反应;③实验时在G和C的混合物表面加入某强氧化剂粉末,在表面上插入一根除去氧化膜的E片,点燃E引发G与C的反应;④I是绿色植物光合作用的原料,温室中常用它作肥料。根据上述信息,回答下列问题: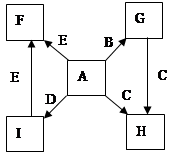

(1)I的电子式为 ,G的俗名是 。
(2)以C和E为电极在NaOH溶液中构成原电池,该原电池的负极反应式为 。
(3)根据E和A反应的能量变化图像写出热化学方程式: 。
(4)两种常见含C元素的盐,一种pH>7,另一种pH<7,写出这两种溶液混合时发生反应的离
子方程式:
(5)写出B在高温下和水蒸气反应的化学方程式并标出电子转移方向和总数 。
(6分)(1)在一定条件下N2与H2反应生成NH3,请回答:
①若反应物的总能量为E1,生成物的总能量为E2,且E1 >E2,则该反应为 (填“吸热”或“放热”)反应。
②已知拆开1mol H-H键,1molN-H键,1molN≡N键分别需要的能量是436kJ、391kJ、946kJ,则N2与H2反应生成NH3的热化学方程式为________________________________。
(2)依据盖斯定律可以对某些难以通过实验直接测定的化学反应的焓变进行推算。
已知:C(s,石墨)+O2(g)=CO2(g) △H1=Q1kJ·mol-1
2CO2(g)+H2 (g)=C2H2(g)+2O2(g) △H2=Q2kJ·mol-1。根据盖斯定律,计算此时由C(s,石墨)和H2(g)生成1mol C2H2(g)反应的焓变为 kJ·mol-1(用含有Q1和Q2的式子表示)。
| 键 | H-H | Br-Br | I-I | Cl-Cl | H-Cl | H-I | H-Br |
| 键能 | 436 | 193 | 151 | 247 | 431 | 299 | 356 |
| ||

| 实验步骤 | 预期现象和结论 |
| 步骤1:取少量吸收液于试管中,滴加3mol?L-1 H2SO4至溶液显酸性,然后将所得溶液分置于A、B试管中. | / |
| 步骤2: | |
| 步骤3: |
| 温度 | K1 | K2 |
| 973K | 1.47 | 2.38 |
| 1173K | 2.15 | 1.67 |
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com