
题目列表(包括答案和解析)
A、HCl和NaOH反应的中和热为57.3 kJ?mol-1,则稀H2SO4和Ba(OH)2溶液发生中和反应的热化学反应方程式为
| ||||||
B、CO的燃烧热是283.0 kJ?mol-1,则表示CO燃烧的热化学方程式为CO(g)+
| ||||||
| C、对于反应:2NO2?N2O4;△H<0.升高温度,正逆反应的速率都增大,但正反应的增速大于逆反应增速 | ||||||
| D、实验测得C与CO的燃烧热分别是393.5kJ?mol-1和283.0kJ?mol-1,则C(s)与O2(g)反应生成CO(g)的反应热为-110.5kJ?mol-1 |
| 溶质 | CH3COONa | NaHCO3 | Na2CO3 | NaClO | NaCN | C6H5ONa |
| pH | 8.8 | 8.1 | 11.6 | 10.3 | 11.1 | 11.3 |
(8分) 硫酸是强酸,中学阶段将硫酸在水溶液中看作完全电离。但事实是,硫酸在水中的第一步电离是完全的,第二步电离并不完全,其电离情况为:
H2SO4=H++HSO4—, HSO4  H++SO42—。
H++SO42—。
请回答下列有关问题:
(1)Na2SO4溶液呈 填“弱酸性”、“中性”或“弱酸性”);
(2)H2SO4溶液与BaCl2溶液反应的离子方程式为 ;
(3)在0.10mol·L—1的Na2SO4溶液中,下列离子浓度关系正确的是 (填写编号)
A.c(Na+)=c(SO42—)+c(HSO4—)+c(H2SO4)
B.c(OH—)=c(HSO4—)+c(H+)
C.c(Na+)+c(H+)=c(OH—)+c(HSO4—)+2c(SO42—)
D.c(Na+)=2 c(SO42—)+2 c(HSO4—)
(4)写出NaHSO4溶液中溶质电离常数(Ka)的表达式 ;
(1)已知在常温下,测得浓度均为0.1 mol·L-1的下列六种溶液的pH:?
溶质 | CH3COONa | NaHCO3 | Na2CO3 | NaClO | NaCN | C6H5ONa |
pH | 8.8 | 9.7 | 11.6 | 10.3 | 11.1 | 11.3 |
复分解反应存在这样一个规律:一种较强酸与一种较弱酸的盐可以自发地反应,生成较弱酸和较强酸的盐,如:?
2CH3COOH + Na2CO3 =2CH3COONa + H2O+CO2↑?
若换个角度看,它同时还揭示出另一条规律,即碱性较强的物质发生类似反应可以生成碱性较弱的物质。依照该规律,请你判断下列反应不能成立的是 (填编号)。?
A.CO2 + H2O + 2NaClO = Na2CO3 + 2HClO?
B.CO2 + H2O + NaClO = NaHCO3 + HClO?
C.CO2 + H2O + C6H5ONa![]() NaHCO3 + C6H5OH?
NaHCO3 + C6H5OH?
D.CO2 + H2O + 2C6H5ONa![]() Na2CO3 + 2C6H5OH?
Na2CO3 + 2C6H5OH?
E.Na2CO3 + C6H5OH![]() NaHCO3 + C6H5ONa?
NaHCO3 + C6H5ONa?
F.CH3COOH + NaCN![]() CH3COONa + HCN?
CH3COONa + HCN?
(2)根据前述信息判断,浓度均为0.05 mol·L-1的下列六种物质的溶液中,pH最小的
是 (填编号),其pH为 (填数值);pH最大的是 (填编号)。
①C6H5OH ②CH3COOH ③HCN ④HClO ⑤H2SO4 ⑥HClO4?
(3)一些复分解反应的发生还遵循其他的规律。下列转化都属于复分解反应:?
①工业上将石灰乳与纯碱溶液混合可制得苛性钠溶液?
②工业上将石灰乳与苦卤(主要溶质KCl、MgCl2)混合可得氢氧化镁固体?
③侯氏制碱法中,向碳酸氢铵饱和溶液中加入饱和食盐水可获得小苏打晶体?
④蒸馏KCl和NaNO3混合溶液,首先析出NaCl晶体?
请根据上述反应,总结出复分解反应发生的另一个规律:?
。?
将KI溶液与AgCl固体混合搅拌,固体变为黄色。该反应也遵循这一规律,请写出反应的化学方程式:_____ 。
某实验小组用0.50 mol·L-1 NaOH溶液和0.50 mol·L-1硫酸溶液进行中和热的测定。
Ⅰ.配制0.50 mol·L-1 NaOH溶液
(1)若实验中大约要使用245 mL NaOH溶液,至少需要称量NaOH固体 g。
(2)从下图中选择称量NaOH固体所需要的仪器是(填字母): 。
|
名称 |
托盘天平 (带砝码) |
小烧杯 |
坩埚钳 |
玻璃棒 |
药匙 |
量筒 |
|
仪器 |
|
|
|
|
|
|
|
序号 |
a |
b |
c |
d |
e |
f |
Ⅱ.测定稀硫酸和稀氢氧化钠中和热的实验装置如图所示。
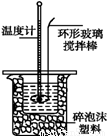
(1)写出该反应中和热的热化学方程式:(中和热为57.3 kJ·mol-1) 。
(2)取50 mL NaOH溶液和30 mL硫酸溶液进行实验,实验数据如下表。
|
温度 实验次数 |
起始温度t1/℃ |
终止温度t2/℃ |
温度差 平均值 (t2-t1)/℃ |
||
|
H2SO4 |
NaOH |
平均值 |
|||
|
1 |
26.2 |
26.0 |
26.1 |
29.6 |
|
|
2 |
27.0 |
27.4 |
27.2 |
31.2 |
|
|
3 |
25.9 |
25.9 |
25.9 |
29.8 |
|
|
4 |
26.4 |
26.2 |
26.3 |
30.4 |
|
①上表中的温度差平均值为 ℃
②近似认为0.50 mol·L-1 NaOH溶液和0.50 mol·L-1硫酸溶液的密度都是1 g·cm-3,中和后生成溶液的比热容c=4.18 J·(g·℃)-1。则中和热ΔH= (取小数点后一位)。
③上述实验数值结果与57.3 kJ·mol-1有偏差,产生偏差的原因可能是(填字母) 。
a.实验装置保温、隔热效果差
b.量取NaOH溶液的体积时仰视读数
c.分多次把NaOH溶液倒入盛有硫酸的小烧杯中
d.用温度计测定NaOH溶液起始温度后直接测定H2SO4溶液的温度
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com