
题目列表(包括答案和解析)
(本题16分)
(1)某化合物结构简式如图,请根据所示的化合物回答问题: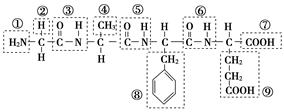
该化合物中,官能团①的名称是________;官能团⑦的名称是________;该化合物是由________个氨基酸分子脱水形成的;写出该化合物水解生成的氨基酸的结构简式(任写一种):________;并写出此氨基酸与氢氧化钠溶液反应的化学方程式:_________________
(2)某有机物含有C、N、H、O四种元素,下图为该有机物的球棍模型。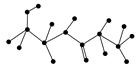
①该有机物的化学式______________________________。
结构简式_______________________________________________ _______。
_______。
②该有机物可能发生的化学反应有(填编号)________。
a.水解 b.加聚c.取代 d.消去e.酯化
③该有机物发生水解反应的化学方程式__________________________________。
(本题16分)
(1)某化合物结构简式如图,请根据所示的化合物回答问题:
该化合物中,官能团①的名称是________;官能团⑦的名称是________;该化合物是由________个氨基酸分子脱水形成的;写出该化合物水解生成的氨基酸的结构简式(任写一种):________;并写出此氨基酸与氢氧化钠溶液反应的化学方程式:_________________
(2)某有机物含有C、N、H、O四种元素,下图为该有机物的球棍模型。
①该有机物的化学式______________________________。
结构简式______________________________________________________。
②该有机物可能发生的化学反应有(填编号)________。
a.水解 b.加聚c.取代 d.消去e.酯化
③该有机物发生水解反应的化学方程式__________________________________。
(本题16分)
(1)某化合物结构简式如图,请根据所示的化合物回答问题:
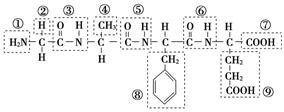
该化合物中,官能团①的名称是________;官能团⑦的名称是________;该化合物是由________个氨基酸分子脱水形成的;写出该化合物水解生成的氨基酸的结构简式(任写一种):________;并写出此氨基酸与氢氧化钠溶液反应的化学方程式:_________________
(2)某有机物含有C、N、H、O四种元素,下图为该有机物的球棍模型。
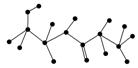
①该有机物的化学式______________________________。
结构简式______________________________________________________。
②该有机物可能发生的化学反应有(填编号)________。
a.水解 b.加聚c.取代 d.消去e.酯化
③该有机物发生水解反应的化学方程式__________________________________。
(16分)(1)在容积为VL的密闭容器中发生2NO2(g)![]() 2NO(g)+O2(g)的反应。
2NO(g)+O2(g)的反应。 反应过程中NO2的物质的量随时间变化的状况如图所示。
反应过程中NO2的物质的量随时间变化的状况如图所示。
①不能说明该反应已达到平衡状态的是 ( )
A.V正(NO2)=2V逆(O2)
B.C(NO2)=C(NO)
C.气体的平均摩尔质量不变
D.NO的体积分数保持不变
②若曲线A和B表示的是该反应在某不同条件下的反应状况,则该不同条件是( )
A.有、无催化剂 B.温度不同 C.压强不同
③写出该反应的化学平衡常数K的表达式________________,并比较K800℃________________K850℃ (填>、<或=)。
(2)在以煤为主要原料的合成氨工业中,原料气氢气常用下述方法获得:
①C+H2O(g)![]() CO+H2;
CO+H2;
②CO+H2O(g)![]() CO2+H2 ;
CO2+H2 ;
已知CO(g)+1/2O2(g)=CO2(g);△H=-283.0kJ/mol ;
H2(g)+1/2O2(g)=H2O(g); △H=-285.8kJ/mol;写出上述CO与H2O(g)反应的热化学方程式。
![]() (3)处理含汞废水的方法很多。下面是常用的两种方法,汞的回收率很高。
(3)处理含汞废水的方法很多。下面是常用的两种方法,汞的回收率很高。
![]()
① 置换法:用废铜屑处理含Hg2+的废水。反应的离子方程式为________________。
② 化学沉淀法:用硫化钠处理含Hg(NO3)2的废水,生成HgS沉淀。已知Ksp(HgS) =1.6×10―52,当废水中c(S2―)=1×10―5mol/L时,c(Hg2+)=________________ 。
(16分)已知硫酸亚铁铵晶体为浅绿色,易溶于水、不溶于乙醇,在水中的溶解度比FeSO4和(NH4)2SO4都要小;能水解;具有还原性,但比硫酸亚铁稳定。
以下是将绿矾(FeSO4?7H2O)、硫酸铵以相等物质的量混合可制得摩尔盐晶体的流程图。根据下图回答:
(1)为处理废铁屑表面的油污,用10%Na2CO3溶液清洗,请用离子方程式表示Na2CO3溶液呈碱性的原因: ▲ 。
(2)步骤1中采用倾析法分离出铁屑,下列适合用倾析法的有 ▲ :
A.沉淀的颗粒较大 B.沉淀容易沉降 C.沉淀呈胶状 D.沉淀呈絮状
(3)步骤2 中铁屑过量的目的是(用离子方程式表示): ▲ 。步骤2中溶液趁热过滤的原因是 ▲ 。
中铁屑过量的目的是(用离子方程式表示): ▲ 。步骤2中溶液趁热过滤的原因是 ▲ 。
(4)步骤3中,加入(NH4)2SO4固体后,应 加热到 ▲ 时,停止加热。需经过的实验操作包括: ▲ 、 ▲ 、减压过滤(或抽滤)等得到较为 ▲ 的晶体。
加热到 ▲ 时,停止加热。需经过的实验操作包括: ▲ 、 ▲ 、减压过滤(或抽滤)等得到较为 ▲ 的晶体。
(5)抽滤装置的仪器有: ▲ 、 ▲ 、安全瓶、抽气泵组成。
(6)产品中Fe2+的定量分析:
制得的摩尔盐样品中往往含有极少量的Fe3+。为了测定摩尔盐产品中Fe2+的含 量,一般采用在酸性下用KMnO4标准液滴定的方法。
量,一般采用在酸性下用KMnO4标准液滴定的方法。
称取4.0 g的摩尔盐样品,溶于水,并加入适量稀硫酸。用0.2 mo1/L KMnO4溶液滴定,当溶液中Fe2+全部被氧化时,消耗KMnO4溶液体积 10.00 mL。
①请完成滴定过程中发生的离子方程式:
Fe2++ MnO4-+( )=" " Mn2++ Fe3++ H2O
②本实验的指示剂 ▲ 。
A.酚酞 B.甲基橙 C.石蕊 D.不需要
③KMnO4溶液置于 ▲ (酸式、碱式)滴定管中
④终点颜色的变化: ▲ 。
⑤产品中Fe2+的质量分数为 ▲ 。 (7)在25℃时,相同物质的量浓度的(NH4)2 CO3、(NH4)2SO4、摩尔盐三种盐溶液a,b,c,其铵根离子浓度由小到大的排列顺序为: ▲ 。(用a,b,c回答)
(7)在25℃时,相同物质的量浓度的(NH4)2 CO3、(NH4)2SO4、摩尔盐三种盐溶液a,b,c,其铵根离子浓度由小到大的排列顺序为: ▲ 。(用a,b,c回答)
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com