
题目列表(包括答案和解析)

[化学——化学与生活](15分)
下列内容都与人们的生活和健康密切相关,请根据要求填空:
(1)学生要注意合理膳食,注意食品的多样化,防止某种营养成分过多或过少。请回答下列问题:
①大米的主要成分在人体内最终变成了 (填名称)而被人体吸收。
②坏血病是由于缺乏维生素C而引起的,下列有关维生素C的说法正确的是 。
A.维生素C是脂溶性维生素,易在体内积存
B.维生素C可作食品添加剂
C.维生素C虽然被称为抗坏血酸,但它的水溶液并不呈酸性
D.维生素C在水溶液中或受热时很容易被氧化,所以生吃新鲜蔬菜要比熟吃时维生素C的损失少
③蔬菜、水果中维生素C的含量较高,缺乏维生素C的同学在膳食中应该增加蔬菜、水果的摄入量,许多蔬菜、水果(如柠檬酸等)是 (填“酸性食物”或“碱性食物”)。
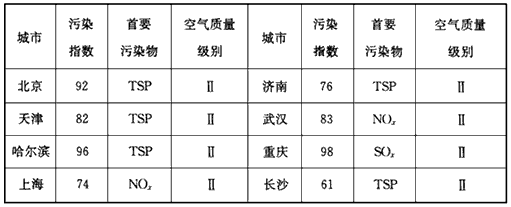
(2)下表是我国部分城市空气质量周报,阅读并回答下列问题:
| 城市 | 污染 指数 | 首要 污染物 | 空气质量级别 | 城市 | 污染 指数 | 首要 污染物 | 空气质量级别 |
| 北京 | 92 | TSP | II | 济南 | 76 | TSP | II |
| 天津 | 82 | TSP | II | 武汉 | 83 | NOx | II |
| 哈尔滨 | 96 | TSP | II | 重庆 | 98 | SOx | II |
| 上海 | 74 | NOx | II | 长沙 | 61 | TSP | II |
| 注:TSP——空气中的飘尘 | |||||||
 。
。| 选项 | 污染物 | 处理措施 | 方法类别 |
| A | 废酸 | 加氢氧化钠中和 | 中和法 |
| B | Cu2+等重金属离子 | 加硫酸盐沉降 | 沉淀法 |
| C | 含苯废水 | 用活性炭吸附 | 物理法 |
| D | 悬浮物 | 加明矾 | 混凝法 |
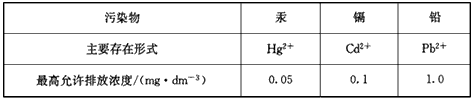
| 污染物 | 汞 | 镉 | 铅 |
| 主要存在形式 | Hg2+ | Cd2+ | Pb2+ |
| 最高允许排放浓度/(mg·dm-3) | 0.05 | 0.1 | 1.0 |
| 元素A | 元素B | 元素C | 元素X | 元素Y | 元素Z |
| 单质是一种常见金属,与元素X形成黑色和砖红色两种化合物 | 单质是一种黄绿色气体 | 短周期中金属性最强,与X反应能生成两种化合物 | 最外层电子数是内层电子数的3倍,能形成双原子阴离子 | 单质为双原子分子,结构中σ键与π键数目比为1:2 | 阳离子就是一个质子 |
四川盛产柠檬,这种果实中富含柠檬酸。柠檬酸有温和爽快的酸味,多用于各种饮料的生产原料,在有机酸的市场中占有率为70%以上。
(1)已知柠檬酸仅由C、H、O三种元素组成。其分子量不超过200,其中含氧元素58.3%。通过计算并写出柠檬酸的分子式_______________。
(2)已知柠檬酸不能被CuO氧化,与氯气反应后的一氯代物只有一种,1 mol 的柠檬酸分别与钠和碳酸氢钠反应生成气体为2 mol 和3 mol,则柠檬酸的结构式为(写入方框内):

(3)柠檬酸和乙醇与浓硫酸共热能发生酯化反应,可生成 种酯类化合物。
(4)柠檬酸可以烃A为主要原料加以合成。已知:
i.烃中既有双键又有三键时,一定条件下三键先发生反应;
ii.

烃A合成柠檬酸的一种合成途径如下,其中1molC与2molHBr反应生成D,D中只含3种不同的氢原子:根据以上信息回答下列问题:

①G中含氧官能团的名称 ;②E→F的反应类型___ _____;
③B的结构简式______________;
④写出指定反应的化学方程式:
G+新制Cu(OH)2: ;
F→G:________ ___ ______ ;
已知环己烯可以通过丁二烯与乙烯发生环化加成反应得到:

 和BrHC=CHBr发生环化加成反应得到化合物A。又知
和BrHC=CHBr发生环化加成反应得到化合物A。又知 是不稳定的。根据题目要求填空:
是不稳定的。根据题目要求填空:

图3-9
(1)通过计算写出莽草酸的分子式______________________。
(2)写出环化加成生成化合物A的反应方程式______________________。
(3)D分子中的官能团名称是______________________。
(4)写出D的具有相同官能团同分异构体的结构简式(至少写出三种稳定结构)____________________________________________。
(5)若将莽草酸与足量的乙醇在浓硫酸作用下加热,可以生成分子式为C9H10O5的新化合物,该反应的化学方程式为_____________________,其反应类型为_____________________。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com