
题目列表(包括答案和解析)
(10分)A、B、C、D分别是由两种短周期元素组成的常见微粒(或粒子),这四种微粒中均含有相同数目的电子,且共含有三种元素。其中A中含有5个原子核,它们之间有如下的反应关系:

(1)A、D的电子式分别为:A  ,D
,D 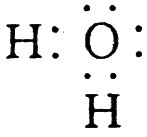 。
。
(2)B、C、D三种微粒结合质子能力x>y>z,(x、y、z分别代表B、C、D中的某一种微粒),则x、y、z分别代表的微粒符号为x OH- ,y NH3 ,z H2O 。
【解析】 A中含5个原子核,又由C+H+→A,推知A为NH![]() ,知C为NH3,B为OH-,D为H2O。
,知C为NH3,B为OH-,D为H2O。
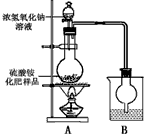
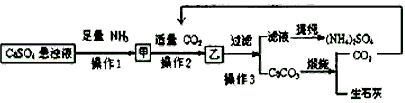
【10分】(NH4)2SO4是农业生产中常见化肥之一,某工厂用石膏、NH3、H2O、CO2制备(NH4)2SO4,首先石膏磨成粉制成CaSO4悬浊液,然后按如下工艺流程进行生产:

(1)操作1与操作2的顺序能否调换?___________(填“能”或“否”),理由是___________
___________________________________。
(2)常温下,CaCO3和CaSO4的溶解度分别为1.5×10-3 g和2.1×10-1 g,请解析CaSO4向CaCO3转化的原因____________________________________________________________________。
(3)判断操作2通入的是“适量CO2”的简单实验方法是_____________________________。
(4)从绿色化学角度考虑,该工艺流程应增加一个操作,这个操作是_________________。
(5)豆腐是日常食品之一,它的制作过程中使用了石膏或盐卤,其中包含的化学原理是__________________________________。

(1)操作1与操作2的顺序能否调换?___________(填“能”或“否”),理由是___________
___________________________________。
(2)常温下,CaCO3和CaSO4的溶解度分别为1.5×10
(3)判断操作2通入的是“适量CO2”的简单实验方法是_____________________________。
(4)从绿色化学角度考虑,该工艺流程应增加一个操作,这个操作是_________________。
(5)豆腐是日常食品之一,它的制作过程中使用了石膏或盐卤,其中包含的化学原理是__________________________________。
(8分)氮是地球上含量丰富的一种元素,氮及其化合物在工农业生产、生活中有着重要作用,
(1)上图是N2(g)和H2(g)反应生成1mol NH3(g)过程中能量变化示意图,请写出N2和H2反应的热化学方程式: ;
(2)若已知下列数据:
| 化学键 | H-H | N≡N |
| 键能/kJ·mol-1 | 435 | 943 |
试根据表中及图中数据计算N-H的键能 kJ·mol-1
(3)合成氨反应通常用铁触媒作催化剂。使用铁触媒后E1和E2的变化是:E1______,E2______(填“增大”、“减小、”“不变”)。
(4)用NH3催化还原NOX还可以消除氮氧化物的污染。例如
4NH3(g)+3O2(g) 2N2(g)+6H2O(g);△H1= akJ·mol-1
N2(g)+O2(g) 2NO(g);△H2= bkJ/mol
若1mol NH3还原NO至N2,则该反应过程中的反应热△H3= kJ/mol(用含a、b的式子表示)
【解析】(1)根据反应进程可判断反应物的能量高,生成物的能量低,所以热化学方程式为N2(g)+3H2(g)2NH3(g) △H=-92 kJ/mol。
(2)反应热就是断键吸收的能量和成键所放出的能量的差值,所以有943kJ/mol+3×435kJ/mol-2×3×x=-92 kJ/mol ,解得x=390 kJ/mol。
(3)催化剂能降低反应的活化能,但不能改变反应热,所以E1和E2均减小。
(4)考查盖斯定律的应用,将已知的2个热化学方程式叠加即得到
4NH3+6NO=6H2O+5N2 △H=(a-3b)kJ/mol。所以1mol NH3还原NO至N2,则该反应过程中的反应热![]() kJ/mol。
kJ/mol。

湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com