A、B、C、D、E、F均为短周期元素,其原子序数依次增大.已知:A的最外层电子数等于其电子层数;B的最外层电子数是次外层电子数的两倍;D是地壳中含量最高的元素;D和F、A和E分别同主族;E是所有短周期主族元素中原子半径最大的元素.根据以上信息回答下列问题:
(1)B与D形成化合物BD
2的结构式为
O═C═O
O═C═O
(2)A、C、D三元素能形成一种强酸甲,写出单质B与甲的浓溶液反应的化学反应方程式
C+4HNO
3(浓)
CO
2↑+4NO
2↑+2H
2O
C+4HNO
3(浓)
CO
2↑+4NO
2↑+2H
2O
.
(3)均由A、D、E、F四种元素组成的两种盐,其相对分子质量相差16,写出它们在溶液中相互作用的离子方程式为
H++HSO3-═SO2↑+H2O
H++HSO3-═SO2↑+H2O
;由B、D、E组成的盐溶于水后溶液显碱性,其原因是(用离子方程式表示)
CO
32-+H
2O

HCO
3-+OH
-CO
32-+H
2O

HCO
3-+OH
-.
(4)C
2A
4─空气燃料电池是一种碱性燃料电池.电解质溶液是20%~30%的KOH溶液.则燃料电池放电时:正极的电极反应式是
O2+2H2O+4e-═4OH-
O2+2H2O+4e-═4OH-
.
(5)已知:2CD
2(g)
C
2D
4(g);△H<0.在恒温恒容条件下,将一定量CD
2和C
2D
4的混合气体通入容积为2L的密闭容器中,反应过程中各物质的物质的量浓度c随时间t的变化关系如图所示.
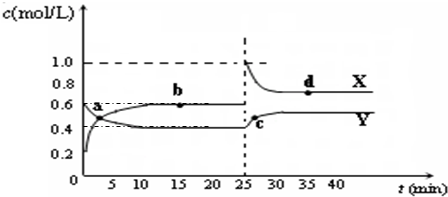
①a、b、c、d四个点中,化学反应处于平衡状态的是
bd
bd
点.
②25min时,增加了
NO2
NO2
(填物质的化学式)
0.8
0.8
mol.
③a、b、c、d四个点所表示的反应体系中,气体颜色由深到浅的顺序是
cdba
cdba
(填字母).

 HCO3-+OH-
HCO3-+OH- HCO3-+OH-
HCO3-+OH-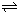 C2D4(g);△H<0.在恒温恒容条件下,将一定量CD2和C2D4的混合气体通入容积为2L的密闭容器中,反应过程中各物质的物质的量浓度c随时间t的变化关系如图所示.
C2D4(g);△H<0.在恒温恒容条件下,将一定量CD2和C2D4的混合气体通入容积为2L的密闭容器中,反应过程中各物质的物质的量浓度c随时间t的变化关系如图所示.