
题目列表(包括答案和解析)
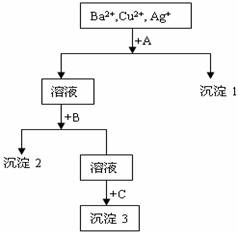
某溶液中含有Ba2+、Cu2+、Ag+三种离子。现用NaOH溶液、盐酸和Na2SO4溶液将这三种离子逐一沉淀分离。
其流程图如右所示(写出最佳答案)
(1)沉淀的化学式:沉淀1 ,沉淀2 ,沉淀3 ;
(2)写出混合液+A的离子方程式: 。
溶液+B的离子方程式: 。

![]()

(苏丹红一号) (苯胺) (2-奈酚)
(1) 苏丹红一号的化学式(分子式)为
(2) 在下面化合物(A)~(D)中,与2-奈酚互为同分异构体的有(填字母代号)
(提示:
![]() 可表示为 )
可表示为 )
(A) (B) (C) (D)
(3)上述化合物(C)含有的官能团是
(4)在适当的条件下,2-奈酚经反应可得到芳香化合物E(C8H6O4),1 mol E与适量的碳酸氢钠溶液反应可放出二氧化碳44.8 L(标准状况),E与溴在有催化剂存在时反应只能生成两种一溴代物,两种一溴代物的结构简式分别是 、 ,E与碳酸氢钠反应的化学方程式是
(5)若将E与足量乙醇在浓硫酸作用下加热,可以生成一个化学式(分子式)为C12H14O4的新化合物,该反应的化学方程式是:
反应类型是 。
答案:苏丹红一号的化学式(分子式)为
I.可供选择的试剂:
A.盐酸 B.氢氧化钠溶液 C.氧气 D.水 E.二氧化碳
Ⅱ.可选用的操作:
①水洗 ②加热 ③高温灼烧 ④过滤 ⑤结晶
编号 粉末状混合物 所加试剂 主要操作
(1) SiO2(CaCO3)
(2) CaCO3(SiO2)
(3) NaCl(SiO2)
(4) SiO2(Fe2O3)
(5) SiO2(H2SiO3)
如何用所提供的试剂和方法除去各粉末状混合物中的杂质(括号内为杂质)。将所选答案的编号填入表中相应的空格内(如果不需要外加试剂,则对应答案栏可空着)。
I.可供选择的试剂:
A.盐酸 B.氢氧化钠溶液 C.氧气 D.水 E.二氧化碳
Ⅱ.可选用的操作:
①水洗 ②加热 ③高温灼烧 ④过滤 ⑤结晶
编号 粉末状混合物 所加试剂 主要操作
(1) SiO2(CaCO3)
(2) CaCO3(SiO2)
(3) NaCl(SiO2)
(4) SiO2(Fe2O3)
(5) SiO2(H2SiO3)
(5分)从A.葡萄糖 B.苯 C.乙醇 D.乙酸 E.油脂 等五种有机物中选择合适的答案,将其标号填在空格内。
(1)工业上制备肥皂的主要原料是 。
(2)能用于除去热水瓶胆水垢〔主要成分:CaCO3 , Mg(OH)2〕的是 。
(3)家居装修材料中散发出的有毒物质是 。
(4)有时医生要在某些发高烧的病人身上涂擦 ,因为该有机物蒸发时,会向人体 (填“吸”或“放”)热。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com