
题目列表(包括答案和解析)
(11分)现有下列物质:
①Cl2 ②SO2 ③0.1mol?L-1Na2CO3
④0.1mol?L-1NH3.H2O ⑤0.1mol?L-1CH3COOH ⑥BaSO4
(1)属于强电解质 属于弱电解质 属于非电解质 ,向⑤中加入等物质的量④,溶液导电性 (填“增强”或“减弱”)
(2)已知③溶液呈碱性,甲同学认为显碱性原因是CO32-水解所致,为证明上述观点是否正确,请设计一个简单的实验,简述实验过程。
。
(3)同学乙认为③溶液中Na2CO3的水解是微弱的,发生水解的CO32-离子不超过其总量的10%。请你设计实验证明该同学的观点是否正确。
。
(4)在T℃时,反应2SO2(g)+O2(g)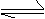 2SO3(g) △H<0的平衡常数K=6×102则:
2SO3(g) △H<0的平衡常数K=6×102则:
①温度升高,化学平衡移动后,平衡常数K值 (填“增大”、“减少”或“不变”)。
②T℃时,某生向容积为2L的密闭容器中充入0.4molSO2、0.18molO2和1.2molSO3的混合气体,此时该反应是否处于化学平衡状态 (填“是”或“否”),化学反应速率V(正) V(逆)(填“大于”、“等于”或“小于”)。
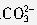 ]+[
]+[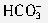 ]+[H2CO3]
]+[H2CO3]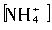 >[H+]>[OH-]
>[H+]>[OH-]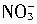 、ClO-、Na+能大量共存
、ClO-、Na+能大量共存B D C C D A B D C B A D C B D C C A B B D A D C A
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com