
题目列表(包括答案和解析)
(1)实验室制备干燥的NH3,根据图甲所示装置回答:
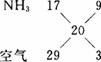
①反应的化学方程式为___________,实验中不选用NaOH制备NH3的原因是______________ ______________________________________,装置中收集NH3的试管口放置棉花团的作用是___________________________________________________________________。
②在a、c之间安装b,是否有必要?___________(填“有”或“没有”),若“有”,应装入___________试剂;(若“没有”,可不答此问)若“没有”,理由是_______________________________________。
(2)实验室欲快速制取大量NH3,根据图乙所示装置回答:
①用化学方程式表示,浓氨水滴入CaO中有大量NH3逸出的原理_______________________。
②检验NH3是否收集满的方法是_______________________________________________。
③测得用排空气法收集到一烧瓶NH3的质量是相同状况下相同体积的H2质量的10倍,若将该烧瓶中NH3做喷泉实验,实验完毕后,烧瓶中水约上升到烧瓶容积的__________(填“几分之几”)。
某课外活动小组在实验室用下图的一些装置组合后,快速制取氨并验证氨的某些性质,同时收集少量纯净氮气,请回答: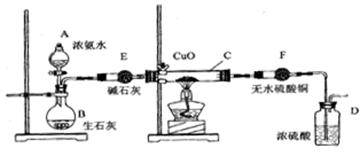
(1)写出用熟石灰和氯化铵反应制氨气的化学方程式
(2) 本实验进行一断时间后,观察到加热的硬质玻璃试管内黑色氧化铜粉末转为红色,盛无水硫酸铜的干燥管内出现蓝色,并且在最后的出气导管处收集到纯净、干燥的氮气。根据这些现象,写出在硬质玻璃试管内发生反应的化学方程式: ,这个反应说明氨气具有____(填编号:A、碱性;B、还原性;C、氧化性; D、不稳定性)
(3) 洗气瓶中盛浓硫酸的主要作用是__________________
(4) 在最后的出气的导管口收集干燥、纯净的氮气,收集方法是:___________
(填编号:A、排气法 B、排水法 C、用气囊收集)
(5)装置E的作用是_______________。装置F验证的气体是___________。
某课外活动小组在实验室用下图的一些装置组合后,快速制取氨并验证氨的某些性质,同时收集少量纯净氮气,请回答:
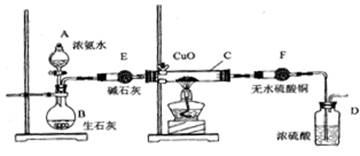
(1)写出用熟石灰和氯化铵反应制氨气的化学方程式
(2) 本实验进行一断时间后,观察到加热的硬质玻璃试管内黑色氧化铜粉末转为红色,盛无水硫酸铜的干燥管内出现蓝色,并且在最后的出气导管处收集到纯净、干燥的氮气。根据这些现象,写出在硬质玻璃试管内发生反应的化学方程式: ,这个反应说明氨气具有____(填编号:A、碱性 ;B、还原性;C、氧化性; D、不稳定性)
(3) 洗气瓶中盛浓硫酸的主要作用是__________________
(4) 在最后的出气的导管口收集干燥、纯净的氮气,收集方法是:___________
(填编号:A、排气法 B、排水法 C、用气囊收集)
(5)装置E的作用是_______________。装置F验证的气体是___________。
氢气在化学工业中有广泛用途。
(1)实验室用锌和稀硫酸制取氢气,反应过程中,溶液中水的电离平衡______移动(填“向左”、“向右”或“不”);若加入少量的_________(填编号),产生氢气速率加快。
A.NaNO3 B.CuSO4 C.CH3COONa D.NaHSO3
工业合成氨的反应原理为N2(g)+3H2(g) 2NH3(g)。实验室模拟化工生产,控制起始浓度均为
2NH3(g)。实验室模拟化工生产,控制起始浓度均为
c(N2)= 1.50 mol/L、c(H2)=2.50 mol/L,分别在三种不同实验条件下反应,N2浓度随时间变化如下图。


| 实验编号 | ①中的物质 | ②中的物质 |
| 1 | 淀粉碘化钾溶液 | 浓硝酸 |
| 2 | 酚酞溶液 | 浓硫酸 |
| 3 | 氯化铝溶液 | 浓氨水 |
| 4 | 湿润的红纸 | 饱和氯水 |

湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com