
题目列表(包括答案和解析)
已知H+(aq) + OH-(aq) = H2O(l) ΔH = - 57.3 kJ·mol-1。以下四个化学反应方程式:
① H2SO4(aq) +2 NaOH(aq) = Na2SO4(aq) + 2 H2O(l);
② H2SO4(aq) + Ba(OH)2(aq) = BaSO4(s) + 2 H2O(l);
③ HCl(aq) + NH3•H2O(aq) = NH4Cl(aq) + H2O(l);
④ CH3COOH(aq) + NH3•H2O(aq) = CH3COONH4(aq) + H2O(l)。
其中反应热为57.3 kJ·mol-1的是( )
A.①和② B.③ C.④ D.以上都不对
已知:H+ (aq)+OH- (aq)= H2O(l);△H1 =" -" 57.3 kJ·mol-1, H2SO4(浓)+ NaOH(aq)=
H2SO4(浓)+ NaOH(aq)= Na2SO4(aq)+ H2O(l);△H2 = m,下列说法正确的是
Na2SO4(aq)+ H2O(l);△H2 = m,下列说法正确的是
| A.上述热化学方程式中的计量数表示分子个数 | B.△H1>△H2 |
| C.△H2 =" -" 57.3 kJ·mol-1 | D.|△H1|>|△H2| |
 H2SO4(浓)+ NaOH(aq)=
H2SO4(浓)+ NaOH(aq)= Na2SO4(aq)+ H2O(l);△H2 = m,下列说法正确的是
Na2SO4(aq)+ H2O(l);△H2 = m,下列说法正确的是| A.上述热化学方程式中的计量数表示分子个数 | B.△H1>△H2 |
| C.△H2 =" -" 57.3 kJ·mol-1 | D.|△H1|>|△H2| |
已知:H+(aq)+OH—(aq)=H2O(l);△H1=—57.3 kJ/mol,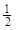 H2SO4(浓)+NaOH(aq)=
H2SO4(浓)+NaOH(aq)=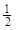 Na2SO4(aq)+ H2O(l);△H2=m。下列说法正确的是
Na2SO4(aq)+ H2O(l);△H2=m。下列说法正确的是
A.上述热化学方程式中的计量数表示分子个数
B.△H1>△H2
C.△H2=—57.3 kJ/mol
D.|△H1|>|△H2|
 H2SO4(浓)+NaOH(aq)=
H2SO4(浓)+NaOH(aq)= Na2SO4(aq)+ H2O(l);△H2=m。下列说法正确的是
Na2SO4(aq)+ H2O(l);△H2=m。下列说法正确的是| A.上述热化学方程式中的计量数表示分子个数 |
| B.△H1>△H2 |
| C.△H2=—57.3 kJ/mol |
| D.|△H1|>|△H2| |
1.C 2.A 3.B 4.C 5.D 6.B 7.D 8.B 9.D 10.D 11.B 12.D 13.A 14.C 15.A 16.B 17.B 18.D 19.B 20.C 21.A 22.A 23.BC 24.CD 25.B
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com