
题目列表(包括答案和解析)
 合成氨工业是极为重要的化学工业,当今对合成氨工业的研究仍然充满活力.其合成原理为:N2(g)+3H2(g)?2NH3(g);△H=-92.2kJ/mol.回答下列问题:
合成氨工业是极为重要的化学工业,当今对合成氨工业的研究仍然充满活力.其合成原理为:N2(g)+3H2(g)?2NH3(g);△H=-92.2kJ/mol.回答下列问题:| 1 |
| 3 |
| 10 | 20 | 30 | 60 | |
| 300 | 52.0 | 64.2 | 71.0 | 84.2 |
| 400 | 25.1 | 38.2 | 47.0 | 65.2 |
| 500 | 10.6 | 19.1 | 26.4 | 42.0 |
(10分)“低碳循环”已经引起了国民的重视,试回答下列问题:
(1)煤的气化和液化可以提高燃料的利用率。
已知25℃,101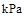 时:
时:

则在25℃,101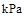 时:
时: .
.
(2)高炉炼铁是CO气体的重要用途之一,其基本反应为:
 ,已知在1100℃时,该反应的化学平衡常数K=0.263。
,已知在1100℃时,该反应的化学平衡常数K=0.263。
①温度升高,化学平衡移动后达到新的平衡,此时平衡常数K值 (填“增大”、“减小”或“不变”);
②1100℃时测得高炉时, ,在这种情况下,该反应是否处于化学平衡状态? (填“是”或“否”),其判断依据是
。
,在这种情况下,该反应是否处于化学平衡状态? (填“是”或“否”),其判断依据是
。
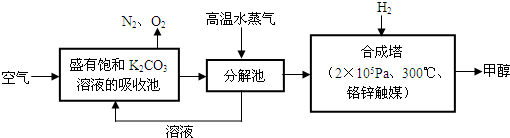
③目前工业上可用 来生产燃料甲醇,有关反应为:
来生产燃料甲醇,有关反应为:
 。现向体积为1L的密闭容器中,充入1mol
。现向体积为1L的密闭容器中,充入1mol 和3mol
和3mol ,反应过程中测得
,反应过程中测得 和
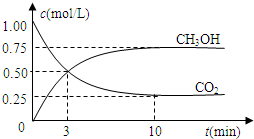
和 (g)的浓度随时间的变化如图所示。
(g)的浓度随时间的变化如图所示。

①从反应开始到平衡,氢气的平均反应速率 ;
;
②下列措施能使 增大的是 (填符号)。
增大的是 (填符号)。
A.升高温度 B.再充入 C.再充入
C.再充入
D.将 (g)从体系中分离
E.充入He(g),使体系压强增大
(g)从体系中分离
E.充入He(g),使体系压强增大
(10分)“低碳循环”已经引起了国民的重视,试回答下列问题:
(1)煤的气化和液化可以提高燃料的利用率。
已知25℃,101![]() 时:
时:![]()
![]()
则在25℃,101![]() 时:
时:![]() .
.
(2)高炉炼铁是CO气体的重要用途之一,其基本反应为:
,已知在1100℃时,该反应的化学平衡常数K=0.263。
①温度升高,化学平衡移动后达到新的平衡,此时平衡常数K值 (填“增大”、“减小”或“不变”);
②1100℃时测得高炉时,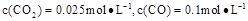 ,在这种情况下,该反应是否处于化学平衡状态? (填“是”或“否”),其判断依据是 。
,在这种情况下,该反应是否处于化学平衡状态? (填“是”或“否”),其判断依据是 。
③目前工业上可用![]() 来生产燃料甲醇,有关反应为:
来生产燃料甲醇,有关反应为:
![]() 。现向体积为1L的密闭容器中,充入1mol
。现向体积为1L的密闭容器中,充入1mol![]() 和3mol
和3mol![]() ,反应过程中测得
,反应过程中测得![]() 和
和![]() (g)的浓度随时间的变化如图所示。
(g)的浓度随时间的变化如图所示。
①从反应开始到平衡,氢气的平均反应速率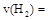 ;
;
②下列措施能使![]() 增大的是 (填符号)。
增大的是 (填符号)。
A.升高温度 B.再充入![]() C.再充入
C.再充入![]()
D.将![]() (g)从体系中分离 E.充入He(g),使体系压强增大
(g)从体系中分离 E.充入He(g),使体系压强增大
(10分)“低碳循环”已经引起了国民的重视,试回答下列问题:
(1)煤的气化和液化可以提高燃料的利用率。
已知25℃,101![]() 时:
时:![]()
![]()
则在25℃,101![]() 时:
时:![]() .
.
(2)高炉炼铁是CO气体的重要用途之一,其基本反应为:
,已知在1100℃时,该反应的化学平衡常数K=0.263。
①温度升高,化学平衡移动后达到新的平衡,此时平衡常数K值 (填“增大”、“减小”或“不变”);
②1100℃时测得高炉时,![]() ,在这种情况下,该反应是否处于化学平衡状态? (填“是”或“否”),其判断依据是 。
,在这种情况下,该反应是否处于化学平衡状态? (填“是”或“否”),其判断依据是 。
③目前工业上可用![]() 来生产燃料甲醇,有关反应为:
来生产燃料甲醇,有关反应为:
![]() 。现向体积为1L的密闭容器中,充入1mol
。现向体积为1L的密闭容器中,充入1mol![]() 和3mol
和3mol![]() ,反应过程中测得
,反应过程中测得![]() 和
和![]() (g)的浓度随时间的变化如图所示。
(g)的浓度随时间的变化如图所示。
①从反应开始到平衡,氢气的平均反应速率 ;
;
②下列措施能使![]() 增大的是 (填符号)。
增大的是 (填符号)。
A.升高温度 B.再充入![]() C.再充入
C.再充入![]()
D.将![]() (g)从体系中分离 E.充入He(g),使体系压强增大
(g)从体系中分离 E.充入He(g),使体系压强增大
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com