
题目列表(包括答案和解析)
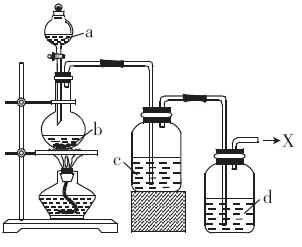
浓盐酸与重铬酸钾[K2Cr2O7(s)]共热时产生某种气体单质X,产物中还有三氯化铬等生成。这种方法制X时便于控制反应,撤去酒精灯则反应停止。现在要制得纯净的X(装置如图)。

(1)加热时,a与b反应的化学方程式__________________________________
(2)液体C的作用是_____________________________________________
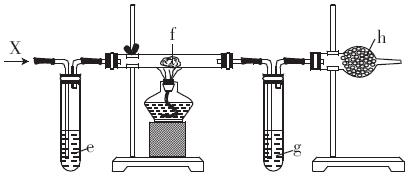
现在把制得的纯净干燥的X通入下图所示的装置。

(3)e是FeBr2溶液,一段时间后观察到的实验现X象是________________________________
(4)f是浸有一种钾盐溶液的棉球,一段时同后观察到试管内有紫色气体,则大试管内发生反应的化学方程式为________________________
(5)g是水和CCl4的混合物,可看到颜色较深的液体在____ (填“上”或“下”)层.
(6)h是碱石灰,则此装置的作用是______________________________________________
A.原子序数小于36的X、Y、Z、W四种元素,其中X是形成化合物种最多的元素,Y原子基态时最外层电子数是其内层电子数的2倍,Z原子基态时2p原子轨道上有3个未成对的电子,W的原子序数为29。
回答下列问题:
(1)![]() 分子中Y原子轨道的杂化类型为 ,1mol
分子中Y原子轨道的杂化类型为 ,1mol![]() 含有
含有![]() 键的数目为 。
键的数目为 。
(2)化合物![]() 的沸点比化合物
的沸点比化合物![]() 的高,其主要原因是 。
的高,其主要原因是 。
(3)元素Y的一种氧化物与元素Z的一种氧化物互为等电子体,元素Z的这种氧化物的分子式是 。
(4)元素W的一种氯化物晶体的晶胞结构如图13所示,该氯化物的化学式是 ,它可与浓盐酸发生非氧化还原反应,生成配合物![]() ,反应的化学方程式为 。
,反应的化学方程式为 。
B.草酸是一种重要的化工产品。实验室用硝酸氧化淀粉水解液制备草酸的装置如图14所示(加热、搅拌和仪器固定装置均已略去)
实验过程如下:
①将一定量的淀粉水解液加入三颈瓶中
②控制反应液温度在55~60℃条件下,边搅拌边缓慢滴加一定量含有适量催化剂的混酸(65%HNO3与98%H2SO4的质量比为2:1.5)溶液
③反应3h左右,冷却,抽滤后再重结晶得草酸晶体。
硝酸氧化淀粉水解液过程中可发生下列反应:
C6H12O6+12HNO3 →3H2C2O4+9NO2↑ +3NO↑ +9H2O
C6H12O6+8HNO3 →6CO2+8NO↑ +10H2O
3H2C2O4+2HNO3 →6CO2+2NO↑ +4H2O
(1)检验淀粉是否水解完全所需用的试剂为
(2)实验中若混酸滴加过快,将导致草酸产率下降,其原因是
(3)装置C用于尾气吸收,当尾气中n(NO2):n(NO)=1:1时,过量的NaOH溶液能将NO,全部吸收,原因是 (用化学方程式表示)
(4)与用NaOH溶液吸收尾气相比较,若用淀粉水解液吸收尾气,其优、缺点是 。
(5)草酸重结晶的减压过滤操作中,除烧杯、玻璃棒外,还必须使用属于硅酸盐材料的仪器有 。
A.原子序数小于36的X、Y、Z、W四种元素,其中X是形成化合物种最多的元素,Y原子基态时最外层电子数是其内层电子数的2倍,Z原子基态时2p原子轨道上有3个未成对的电子,W的原子序数为29。
回答下列问题:
(1) 分子中Y原子轨道的杂化类型为 ,1mol
分子中Y原子轨道的杂化类型为 ,1mol 含有
含有 键的数目为 。
键的数目为 。
(2)化合物 的沸点比化合物
的沸点比化合物 的高,其主要原因是
的高,其主要原因是  。
。
(3)元素Y的一种氧化物与元素Z的一种氧化物互为等电子体,元素Z的这种氧化物的分子式是 。
(4)元素W的一种氯化物晶体的晶胞结构如图13所示,该氯化物的化学式是 ,它可与浓盐酸发生非氧化还原反应,生成配合物 ,反应的化学方程式为 。
,反应的化学方程式为 。
B.草酸是一种重要的化工产品。实验室用硝酸氧化淀粉水解液制备草酸的装置如图14所示(加热、搅拌和仪器固定装置均已略去)
实验过程如下:
①将一定量的淀粉水解液加入三颈瓶中
②控制反应液温度在55~60℃条件下,边搅拌边缓慢滴加一定量含有适量催化剂的混酸(65%HNO3与98%H2SO4的质量比为2:1.5)溶液
③反应3h左右,冷却,抽滤后再重结晶得草酸晶体。
硝酸氧化淀粉水解液过程中可发生下列反应:
C6H12O6+12HNO3 →3H2C2O4+9NO2↑ +3NO↑ +9H2O
C6H12O6+8HNO3 →6CO2+8NO↑ +10H2O
3H2C2O4+2HNO3 →6CO2+2NO↑ +4H2O
(1)检验淀粉是否水解完全所需用的试剂为
(2)实验中若混酸滴加过快,将导致草酸产率下降,其原因是
(3)装置C用于尾气吸收,当尾气中n(NO2):n(NO)=1:1时,过量的NaOH溶液能将NO,全部吸收,原因是 (用化学方程式表示)
(4)与用NaOH溶液吸收尾气相比较,若用淀粉水解液吸收尾气,其优、缺点是 。
(5)草酸重结晶的减压过滤操作中,除烧杯、玻璃棒外,还必须使用属于硅酸盐材料的仪器有 。
一、选择题(每小题3分,共51分)
题号
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
17
答案
A
C
C
C
C
C
B
D
A
B
B
D
B
C
A
C
D
二、填空题(21题(1)问每空1分,其余每空2分,共19分)
18.(10分)(1)① (2)①⑤ (3)4 (4)>7 (5)D
19.(8分)(1)

(2)
(3)
 20.(9分)(1)
20.(9分)(1)

 (各1分)
(各1分)
(2)
(3) (4)
(4)

21.(14分)(1)试管上部充满红棕色气体
(2)无; 与水反应生成了足量的
与水反应生成了足量的 ,中和了
,中和了
(3)
 只写第一个给全分
只写第一个给全分
(4) ;
; ;小
;小
22.(8分)(1)
(2)A、D
(3)3 

湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com