
题目列表(包括答案和解析)
| 实验装置 | 实验现象 | 实验结论 |
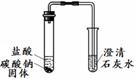 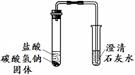 实验Ⅰ 实验Ⅱ | 实验I、II中均观察到:白色固体逐渐减少, ;澄清石灰水变浑浊。 | Na2CO3和NaHCO3都能与盐酸反应产生CO2;NaHCO3与盐酸反应的化学方程式是 。 |
| | t1/℃ | t2/℃ | t3/℃ |
| Na2CO3 | 23.3 | 20.0 | 23.7 |
| NaHCO3 | 18.5 | 20.0 | 20.8 |
酸雨是大气污染的危害之一,二氧化硫(SO2)的含量是空气质量监测的一个重要指标。某兴趣小组同学收集某地的雨水进行实验。
【相关信息】①每隔1 h,通过pH计测定雨水样品的pH,测得的结果如下表:
| 测定时间/h | 0 | 1 | 2 | 3 | 4 |
| 雨水样品的pH | 4.73 | 4.62 | 4.56 | 4.55 | 4.55 |
②SO2能使品红溶液褪色;
③pH<5.6的雨水为酸雨;
④海水呈弱碱性;
⑤BaSO3不溶于水,能与盐酸反应;BaSO4不溶于水,也不溶于盐酸。
【分析讨论】①正常雨水的pH范围是:7> pH> 5.6,偏酸性,这是因为 。
②酸雨能腐蚀金属制品,从基本反应类型上看主要反应属于 。
③收集的酸雨样品放置一段时间后pH减小,原因是SO2与水反应生成的H2SO3被氧化为H2SO4。试写出该反应的化学方程式 。
【提出猜想】同学们对刚收集到的酸雨样品中的溶质进行猜想:
猜想Ⅰ:酸雨中溶质只含有H2SO3;
猜想Ⅱ:酸雨中溶质只含有H2SO4;
猜想Ⅲ:酸雨中溶质 。
【实验探究】
(1)向刚收集的酸雨样品中滴加过量Ba(OH)2溶液,有白色沉淀生成,过滤。
①在滤液中滴加 溶液,溶液呈 色。证明在酸雨样品中滴加的Ba(OH)2溶液已过量。
②向沉淀中加入足量盐酸,沉淀部分溶解且放出有刺激性气味气体。该反应的化学方程式为 ,根此现象有关酸雨中溶质的猜想 正确。
(2)某同学取酸雨样品V L,加入17.1%的Ba(OH)2溶液至不再产生沉淀时,恰好消耗10.00 g Ba(OH)2溶液。该V L酸雨样品中溶解SO2的质量为 。
【实验反思】在某些酸雨中还可分析出有硝酸存在,这是由于空气中含有某元素+4价氧化物的原因,这种氧化物的化学式为 。
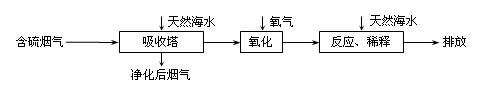
【拓展延伸】利用海水脱硫是减少SO2排放的有效方法,其工艺流程如下图所示:

天然海水吸收了较多的含硫烟气后,有H2SO3生成,H2SO3与海水中的离子反应,会释放出CO2,通入氧气后氧化后,海水的酸性显著增强。
①设计一种检验净化后的烟气中是否含SO2的简单的实验方案: 。
②氧化后的海水需要用大量的天然海水与之混合后才能排放,该操作的主要目的是
。
| 测定时间/h | 0 | 1 | 2 | 3 | 4 |
| 雨水样品的pH | 4.73 | 4.62 | 4.56 | 4.55 | 4.55 |
酸雨是大气污染的危害之一,二氧化硫(SO2)的含量是空气质量监测的一个重要指标。某兴趣小组同学收集某地的雨水进行实验。
【相关信息】①每隔1 h,通过pH计测定雨水样品的pH,测得的结果如下表:
| 测定时间/h | 0 | 1 | 2 | 3 | 4 |
| 雨水样品的pH | 4.73 | 4.62 | 4.56 | 4.55 | 4.55 |

| 测定时间/h | 0 | 1 | 2 | 3 | 4 |
| 雨水样品的pH | 4.73 | 4.62 | 4.56 | 4.55 | 4.55 |

湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com