
题目列表(包括答案和解析)
生物质能是一种洁净、可再生的能源。生物质气(主要成分为CO、CO2、H2等)与H2混合,催化合成甲醇是生物质能利用的方法之一。
![]() (1)上述反应的催化剂含有Cu、Zn、Al等元素。写出基态Zn原子的核外电子排布式 。
(1)上述反应的催化剂含有Cu、Zn、Al等元素。写出基态Zn原子的核外电子排布式 。
![]() (2)根据等电子原理,写出CO分子结构式 。
(2)根据等电子原理,写出CO分子结构式 。
![]() (3)甲醇催化氧化可得到甲醛,甲醛与新制Cu(OH)2的碱性溶液反应生成Cu2O沉淀。
(3)甲醇催化氧化可得到甲醛,甲醛与新制Cu(OH)2的碱性溶液反应生成Cu2O沉淀。
![]() ①甲醇的沸点比甲醛的高,其主要原因是 ;甲醛分子中碳原子轨道的杂化类型为 。
①甲醇的沸点比甲醛的高,其主要原因是 ;甲醛分子中碳原子轨道的杂化类型为 。
![]() ②甲醛分子的空间构型是 ;1mol甲醛分子中σ键的数目为 。
②甲醛分子的空间构型是 ;1mol甲醛分子中σ键的数目为 。
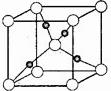
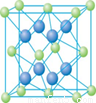
![]() ③在1个Cu2O晶胞中(结构如图所示),所包含的Cu原子数目为 。
③在1个Cu2O晶胞中(结构如图所示),所包含的Cu原子数目为 。
生物质能是一种洁净、可再生的能源。生物质气(主要成分为CO、CO2、H2等)与
H2混合,催化合成甲醇是生物质能利用的方法之一。
(1)上述反应的催化剂含有Cu、Zn、Al等元素。写出基态Zn原子的核外电子排布式 。
(2)根据等电子原理,写出CO分子结构式 。
(3)甲醇催化氧化可得到甲醛,甲醛与新制Cu(OH)2的碱性溶液反应生成Cu2O沉淀。
 ①甲醇的沸点比甲醛的高,其主要原因是 ;甲醛分子中碳原子轨道的杂化类型为 。
①甲醇的沸点比甲醛的高,其主要原因是 ;甲醛分子中碳原子轨道的杂化类型为 。
②甲醛分子的空间构型是 ;1mol甲醛分子中σ键的数目为 。
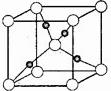
③在1个Cu2O晶胞中(结构如图所示),所包含的Cu原子数目为 。
生物质能是一种洁净、可再生能源。生物质气(主要成分为 CO、CO2、H2等)与 H2混合,催化合成甲醇是生物质能利用的方法之一。
(1)上述反应的催化剂含有 Cu、Zn、Al 等元素。写出基态 Cu2+离子的核外电子排布式_______________________________________;
(2)根据等电子原理,写出 CO 分子的结构式______________________;
(3)甲醇催化氧化可得到甲醛,甲醛与新制 Cu(OH)2的碱性溶液反应生成 Cu2O 沉淀。
①甲醛分子中碳原子轨道的杂化类型为_____________________;
②甲醛分子的空间构型是__________________;
③ 1 mol 甲醛分子中 σ 键的数目为__________________。
生物质能是一种洁净、可再生能源。生物质气(主要成分为 CO、CO2、H2 等)与H2混合,催化合成甲醇和二甲醚(CH3OCH3)及许多烃类物质等,是生物质能利用的方法之一.
(1)已知碳的气化反应在不同温度下平衡常数的对数值(lgK)如下表:

反应:CO(g)+H2O(g) CO2(g)+H2(g),该反应的△H________0(选填:“>”、“<”、“=”);在900K时,该反应平衡常数的对数值(lgK)=_____________.
CO2(g)+H2(g),该反应的△H________0(选填:“>”、“<”、“=”);在900K时,该反应平衡常数的对数值(lgK)=_____________.
(2)甲醇是一种重要的能源和化工原料,工业上合成甲醇的反应为:CO+2H2⇌CH3OH.现已知:H2(g)、CO(g)、CH3OH(l)的燃烧热ΔH分别为-285.8KJ/mol、-283.0KJ/mol和-726.5KJ/mol。则:CH3OH不完全燃烧生成CO和液态H2O的热化学反应方程式 .
(3)在一定温度、压强和催化条件下,工业上用CO和H2反应生成二甲醚,同时产生一种参与大气循环的无机物。则该反应的化学反应方程式为: .
(4)下图左为绿色电源“二甲醚燃料电池”的工作原理示意图.a电极上发生反应的电极反应式为 .
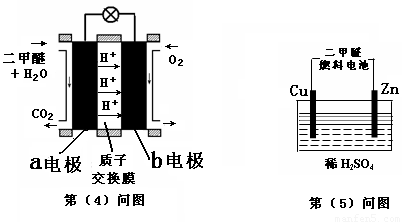
(5)连接下图右装置的电源为(4)问中的二甲醚燃料电池。接通电源一段时间后,观察到装置中电解质溶液颜色由无色变为蓝色,并逐渐加深。则该装置中的Cu电极应与二甲醚燃料电池中 电极(填a或b)相连。通电时发生反应的总的离子反应方程式为: .
生物质能是一种洁净、可再生能源。生物质气(主要成分为CO、CO2、H2等)与混合,在含有Zn、Cu等元素的催化剂条件下能合成一种生物质能——甲醇。
(1) 与CO互为等电子体的物质的化学式是 。
(2) CO2分子中碳原子的杂化类型是 杂化。
(3) 按电子排布Zn在元素周期表中属于 区,
其晶体属于六方最密堆积,它的配位数是 。
(4) Cu的一种氯化物晶体的晶胞结构如图所示。(空心球代表氯离子),则一个晶胞中所含的数目是 。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com