(2013?泰安二模)近年来,以天然气等为原料合成甲醇的难题被一一攻克,极大地促进了甲醇化学的发展.
(1)与炭和水蒸气的反应相似,以天然气为原料也可以制得CO和H
2,该反应的化学方程式为
.
(2)合成甲醇的一种方法是以CO和H
2为原料,其能量变化如图1所示:
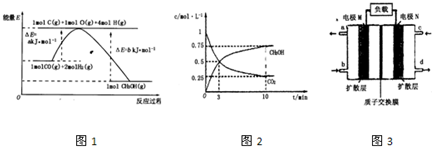
由图可知,合成甲醇的热化学方程式为
CO(g)+2H2(g)?CH3OH(g)△H=(a-b)kJ/mol
CO(g)+2H2(g)?CH3OH(g)△H=(a-b)kJ/mol
.
(3)以CO
2为原料也可以合成甲醇,其反应原理为:CO
2(g)+3H
2(g)?CH
3OH(g)+H
2O(g)
①在lL的密闭容器中,充入1molCO
2和3molH
2,在500℃下发生反应,测得CO
2(g)和CH
3OH(g)的浓度随时问变化如图2所示:
则下列说法正确的是
BD
BD
(填字母);
A.3min时反应达到平衡
B.0~10min时用H2表示的反应速率为0.225mol?
-1?min
-1C.CO
2的平衡转化率为25%
D.该温度时化学平衡常数为
(mol?L-1)-2②在相同温度、相同容积的3个密闭容器中,按不同方式投入反应物,保持恒温、恒容,测得反应达到平衡时的有关数据如下:
| 容器 |
容器1 |
容器2 |
容器3 |
| 反应物投入量(始态) |
1molCO2、3molH2 |
0.5molCO2、1.5molH2 |
1molCH3OH、1molH2O |
| CH3OH的平衡浓度/mol?L-1 |
c1 |
c2 |
c3 |
| 平衡时体系压强/Pa |
p1 |
p2 |
p3 |
则下列各量的大小关系为c
1等于
等于
c
3,p
2小于
小于
p
3(填“大于”、“等于”或“小于”).
(4)近年来,甲醇燃料电池技术获得了新的突破,如图3所示为甲醇燃料电池的装置示意图.电池工作时,分别从b、c充入CH
3OH、O
2,回答下列问题:
①从d处排出的物质是
水
水
,溶液中的质子移向电极
N
N
(填“M”或“N”);
②电极M上发生的电极反应式为
CH3OH+H2O-6e-=CO2+6H+
CH3OH+H2O-6e-=CO2+6H+
.

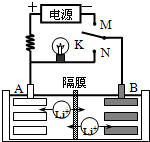 (2011?泰州二模)图是一种可充电的锂离子电池充放电的工作示意图.放电时该电池的电极反应式为:
(2011?泰州二模)图是一种可充电的锂离子电池充放电的工作示意图.放电时该电池的电极反应式为:
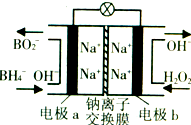 (2013?漳州二模)某新型电池,以NaBH4(B的化合价为+3价)和H2O2作原料,该电池可用作深水勘探等无空气环境电源,其工作原理如图所示.下列说法正确的是( )
(2013?漳州二模)某新型电池,以NaBH4(B的化合价为+3价)和H2O2作原料,该电池可用作深水勘探等无空气环境电源,其工作原理如图所示.下列说法正确的是( )