
题目列表(包括答案和解析)
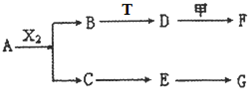 下列物质有如下转化关系(有的生成物未列出,反应条件均省略),其中:A在常温下是一种气体,能使湿润的红色石蕊试纸显蓝色,D为碱,G为酸,金属甲在G 的浓溶液中会钝化;F的溶液中只含一种溶质.
下列物质有如下转化关系(有的生成物未列出,反应条件均省略),其中:A在常温下是一种气体,能使湿润的红色石蕊试纸显蓝色,D为碱,G为酸,金属甲在G 的浓溶液中会钝化;F的溶液中只含一种溶质.
| ||
| △ |
| ||
| △ |
下列框图表示电解A的稀溶液以及一些常见物质间的转化关系,图中所有反应物、生成物及溶液中的水均未标出,C、D、E、F、I均为单质,其中C、D、E为气体,J为淡黄色固体,O为红褐色固体,L分子式为N2H4

请回答下列问题:
(1)写出下列反应的化学方程式:反应⑤ 。反应⑦ 。
(2)N2H4是强还原剂,与氧化剂反应时放出大量的热,如
N2H4(1)+2H2O2(1)=N2(g)+4H2O(g)![]() kJ/mol
kJ/mol
因此,N2H4可以作为火箭的推进剂。据此,你认为在常温下,氮气和水蒸气 (填“能”或“不能”)自发反应生成N2H4(1)和H2O2(1),原因是 。
(3)电解A溶液的过程中,如在阳极产生C、E气体的体积均为2.24 L(标准状况),则在阴极产生气体的体积(标准状况)为 。


题号
1
2
3
4
5
6
7
8
答案
C
A
A
B
C
D
B
B
题号
9
10
11
12
13
14
15
答案
C
D
B
B
B
C
D
16.(8分,每空两分)
H O
| ||
(1)HOCH2CH2―N―C―CH3
(2)②
NH2 O
| ||
(3)①CH3CH2CH―C―OH
NO2 NO2
| |
②CH3CH―CH2CH2CH3 CH3CH―CH(CH3)2
|