(2012?顺义区二模)二氧化硫是形成酸雨的罪魁祸首之一.化学小组的同学想对二氧化硫进行研究,依据化学方程式Zn+2H
2SO
4浓ZnSO
4+SO
2↑+2H
2O计算后.取一定量的锌粉与98%的浓硫酸恰好完全反应.
提出问题:对于制得的气体,有同学认为可能含有杂质.
猜想与假设:化学小组制得的SO
2中混有的杂质主要是H
2.产生这一结果的主要原因是
锌与浓硫酸反应消耗部分硫酸,并生成水,使溶液浓度降低成稀硫酸,发生Zn+H2SO4(稀)=ZnSO4+H2↑
锌与浓硫酸反应消耗部分硫酸,并生成水,使溶液浓度降低成稀硫酸,发生Zn+H2SO4(稀)=ZnSO4+H2↑
(用化学方程式和必要的文字说明).
查阅资料:(1)CO
2能与水、
碱溶液
碱溶液
反应,SO
2与CO
2一样,也能.
(2)H
2与CO一样,能将金属氧化物冶炼成金属.
(3)CaSO
3难溶于水
实验验证:为证实相关分析,化学小组的同学设计了下图所示装置进行实验.
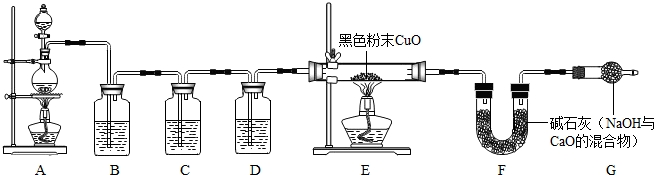
(1)B装置的作用是
除去二氧化硫
除去二氧化硫
.
(2)混合气体中含有氢气,则E装置中观察到的现象是
氧化铜由黑色变为红色,玻璃管内壁有水雾
氧化铜由黑色变为红色,玻璃管内壁有水雾
,反应的化学方程式为
.
实验反思:小芳认为,利用上述装置可以测定混合气体中二氧化硫和氢气的质量比,要达到这一目的,实验小组必须测定下列数据中的
AB
AB
(填字母).
A.参加反应的锌的质量 B.装置B的质量增量
C.氧化铜的质量 D.装置 F的质量增量.

 (2013?平顶山一模)金属用途广泛,其结构和性质等是化学的重要研究内容.
(2013?平顶山一模)金属用途广泛,其结构和性质等是化学的重要研究内容.