
题目列表(包括答案和解析)
(4分)已知2NH3(g) N2(g) +3 H2(g) ;在某温度下,在2 L密闭容器中加入一定量的NH3 ,反应到10分钟时各组分的浓度不再改变,此时测得各组分的浓度如下:
| 物质 | NH3 | N2 | H2 |
| 物质的量(mol) | 0. 1 | 0.2 | 0.6 |
该时间内平均反应速率v(N2) =
达到平衡状态后,下列说法正确的是:
a.通过改变反应条件可使现有平衡移动
b.NH3的分解速率和合成速率相等
c.NH3不再分解了
d.通过改变反应条件可使NH3全部分解成N2和 H2
已知N≡N键的键能是a kJ﹒mol-1,H-H键的键能是b kJ﹒mol-1,N-H键的键能是c kJ﹒mol-1,则N2(g) + 3 H2(g) =" 2" NH3(g)的△H(单位:kJ﹒mol-1)为
| A.3c–a-b | B.a+b-3c | C.a+3b-2c | D.a+3b-6c |
尿素(H2NCONH2)是一种非常重要的高氮化肥,在工农业生产中有着非常重要的地位。
(1)工业上合成尿素的反应如下:
2NH3(l)+CO2(g) H2O(l)+H2NCONH2(l)
△H=-103.7 kJ·mol-1
H2O(l)+H2NCONH2(l)
△H=-103.7 kJ·mol-1
下列措施中有利于提高尿素的生成速率的是
A.采用高温
B.采用高压
C.寻找更高效的催化剂
D.减小体系内CO2浓度
(2)合成尿素的反应在进行时分为如下两步:
第一步:2NH3(l)+CO2(g)
 H2NCOONH4(氨基甲酸铵)(l) △H1
H2NCOONH4(氨基甲酸铵)(l) △H1
第二步:H2NCOONH4(l)
 H2O(l)+H2NCONH2(l)
△H2.
H2O(l)+H2NCONH2(l)
△H2.
某实验小组模拟工业上合成尿素的条件,在一体积为0.5 L密闭容器中投入4 mol氨和l mol二氧化碳,实验测得反应中各组分随时间的变化如下图I所示:

①已知总反应的快慢由慢的一步决定,则合成尿素总反应的快慢由第 步反应决定,总反应进行到 min时到达平衡。
②第二步反应的平衡常数K随温度的变化如上图II所示,则△H2 0(填“>” “<” 或 “=”)
(3)在温度70-95℃时,工业尾气中的NO、NO2可以用尿素溶液吸收,将其转化为N2
①尿素与NO、NO2三者等物质的量反应,化学方程式为
②已知:N2(g)+O2(g)=2NO(g).△H=180.6 kJ·mol-1
N2(g)+3H2(g)=2NH3(g) △H=-92.4 kJ·mol-1
2H2(g)+O2(g)=2H2O(g) △H=-483.6 kJ·mol-1
则4NO(g)+4NH3(g)+O2(g)=4N2(g)+6H2O(g) △H= kJ·mol-1
(4)尿素燃料电池结构如上图III所示。其工作时负极电极反应式
可表示为 。
工业上以NH3为原料经过一系列反应可以得到HNO3。
(1)工业上NH3的催化氧化反应方程式为
;为了尽可能多地实现 向
向 的转化,请你提出一条可行性建议 。
的转化,请你提出一条可行性建议 。
(2)将工业废气NO与CO混合,经三元催化剂转化器处理如下:2CO+2NO 2CO2+N2。
2CO2+N2。
已知:
CO(g)+  O2(g)=CO2(g)
△H=-283.0kJ·mol-1
O2(g)=CO2(g)
△H=-283.0kJ·mol-1
N2(g)+O2(g)=2NO(g) △H=+180.0kJ·mol-1
三元催化剂转化器中发生反应的热化学方程式为 ;
为了测定在某种催化剂作用下的反应速率,在某温度下用气体传感器测得不同时间的NO和CO浓度部分数据记录如下:
|
时间/s |
0 |
2 |
3 |
4 |
|
c(NO)/mol·L-1 |
1.00×10-3 |
1.50×10-4 |
1.00×10-4 |
1.00×10-4 |
|
|
|
|
|
|
①前2s内的平均反应速率v(CO)= ;
②在该温度下,反应的平衡常数K= ;
③假设在密闭容器中发生上述反应,达到平衡时下列措施能提高CO转化率的是
A.选用更有效的催化剂 B.恒容下充入Ar
C.适当降低反应体系的温度 D.缩小容器的体积
化学反应N2+3H2=2NH3的能量变化如图所示,E是正值,该反应的热化学方程式是
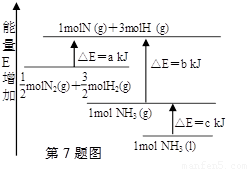
A.N2(g)+3H2(g)=2NH3(1); △H=2(a-b-c)kJ·mol-1
B. N2(g)+3H2(g)=2NH3(g); △H=2(b-a)kJ·mol-1
C.1/2N2(g)+3/2H2(g)=NH3(1); △H=(b+c-a)kJ·mol-1
D.1/2N2(g)+3/2H2(g)=NH3(g); △H=(a+b)kJ·mol-1
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com