
题目列表(包括答案和解析)
某电解质溶液中,可能大量存在有 、
、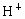 、
、 、
、 、
、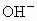 、
、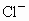 ,你认为一定有的离子是_________,一定没有的离子是_____________;还需要进一步确认的离子是_________,怎样判断有无?____________.
,你认为一定有的离子是_________,一定没有的离子是_____________;还需要进一步确认的离子是_________,怎样判断有无?____________.
某电解质溶液中,可能大量存在有 、
、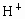 、
、 、
、 、
、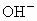 、
、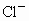 ,你认为一定有的离子是_________,一定没有的离子是_____________;还需要进一步确认的离子是_________,怎样判断有无?____________.
,你认为一定有的离子是_________,一定没有的离子是_____________;还需要进一步确认的离子是_________,怎样判断有无?____________.
(1)某电解质溶液中,可能大量存在有Ag+、H+、Cu2+、CO32-、OH-、Cl-离子,你认为一定大量存在的离子是________,一定不能大量存在的离子是________;
(2)把1 mol Na和1 mol Mg分别投入到过量的且等质量的盐酸中,分别得到溶液a和b,则溶液a和b的质量关系为ma________mb.(填“>”、“<”、“=”)
(3)下图为实验室某浓盐酸试剂瓶的标签上的有关数据,试根据标签上的有关数据回答下列问题:

①该浓盐酸中HCl的物质的量浓度为________mol/L.
②配制0.1 mol/L 500 mL稀盐酸,需要量取________mL上述浓盐酸.
步骤1:取一定量的粗盐,置于烧杯中,加入足量的水,配成粗盐水;
步骤2:向粗盐水中加入除杂试剂,然后进行过滤,滤去不溶物,再向滤液中加入盐酸调节盐水的pH;
步骤3:将得到的溶液蒸发浓缩、冷却、结晶、过滤、烘干即得精盐。
请回答下列问题:
(1)上述实验中的过滤操作需要烧杯、____________、____________等玻璃仪器。
(2)步骤2中常用Na2CO3、NaOH、BaCl2作为除杂试剂,则加入除杂试剂的顺序为_______________________。
(3)步骤2中,判断加入BaCl2已过量的方法是_______________________。
(4)步骤2中,若先用盐酸调节pH再过滤,将会对实验结果产生影响,其原因是_______
______________________________________________________。
(5)为检验精盐纯度,需配制150 mL 0.2 mol·L-1 NaCl(精盐)溶液,下图是该同学转移溶液的示意图,图中的两处错误是:

____________________________________________________________________,
____________________________________________________________________。
若在定容时仰视,则所配溶液的浓度__________0.2 mol·L-1(填“大于”或“小于”);若定容不慎超过刻度线,应采用的处理方法是________________________。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com