
题目列表(包括答案和解析)
| 实验编号 | c(HA)/mol?L-1 | c(NaOH)/mol?L-1 | 反应后溶液pH |
| 甲 | 0.1 | 0.1 | pH=9 |
| 乙 | c1 | 0.2 | pH=7 |
(12分)七水硫酸镁(MgSO4?7H2O)为白色细小四角柱状结晶,无臭,味苦,在干燥空气中易风化,易溶于水,缓溶于甘油,微溶于乙醇,热至68℃以上熔化。在印染、造纸和医药等工业上都有广泛的应用,利用化工厂生产硼砂的废渣――硼镁泥可制取七水硫酸镁。
表1 硼镁泥的主要化学成分
成分 | MgO | SiO2 | Fe2O3 | CaO | B2O3 | Al2O3 | MnO | CO2 |
质量分数% | 25-38 | 18-25 | 6-15 | 1-3 | 1-2 | 1-2 | 1-2 | 15-20 |
表2 部分阳离子以氢氧化物形式完全沉淀时溶液的pH
沉淀物 | Al(OH)3 | Fe(OH)3 | Fe(OH)2 | Mn(OH)2 | Mg(OH)2 |
pH值 | 4.7 | 3.2 | 9.7 | 10.4 | 11.2 |
硼镁泥制取七水硫酸镁的工艺流程如下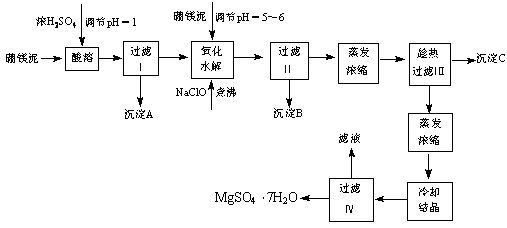
根据以上流程图并参考表格数据,试回答下列问题:
⑴ 硼镁泥是硼镁矿生产硼砂(Na2B4O7?10H2O)时的废渣。将硼镁矿(2MgO?B2O)锻烧、粉碎后加水和纯碱,在加热加压下通入CO2可得硼砂。此反应为熵减小反应, 试写出反应方程式: 。
⑵ 沉淀A中除二氧化硅外,还含有硼酸,硼酸微溶于水,为一元弱酸,其酸性不来源于羟基的电离,写出硼酸水溶液电离方程式 。
⑶ CaSO4的溶解度随温度升高变化不明显,在得到沉淀C时,对蒸发浓缩后的溶液却要进行趁热过滤,原因是 。
⑷ 经对沉淀B进行分析,发现其中含有二氧化锰,用方程式解释原因: 。
⑸ 用正三辛胺(TOA)做萃取剂,磺化煤油做稀释剂,通过有机萃取也可以用来除去硫酸镁浸出液中的铁。其主要反应如下:
Fe2++H2O=Fe(OH)2++H+ ⑴
Fe(OH)2++SO42-=Fe(OH)SO4 ⑵
2R3N+H2SO4=(R3NH)2SO4 ⑶
Fe(OH)SO4+(R3NH)2SO4=Fe(OH)SO4?(R3NH)2SO4 ⑷
试问:浸出液初始pH须加H2SO4调至0.9左右,pH>1.5时不利于萃取。试给出须加H2SO4的两个理由
![]() 。
。
![]() pH<0.5亦不利于萃取,给出其主要原因
pH<0.5亦不利于萃取,给出其主要原因 ![]() 。
。
| 组别 | NH3·H2O | HCl | 混合溶液的pH值 |
| 甲 | c(NH3·H2O)=0.1mol·L-1 | c(HCl)=0.1mol·L-1 | pH=a |
| 乙 | NH3·H2O的pH=12 | HCl的pH=2 | pH=b |
| 丙 | c(NH3·H2O)="A" mol·L-1 | c(HCl)=0.1mol·L-1 | pH=c |
(9分)常温下,将某一元酸HA和NaOH溶液等体积混合,两种溶液的浓度和混合后所得溶液的pH如下表:
实验编号 | HA | NaOH | 混合溶液的pH |
甲 | c(HA)=0.2 mol/L | c(NaOH)=0.2 mol/L | pH=a |
乙 | c(HA)=c1 mol/L | c(NaOH)=0.2 mol/L | pH=7 |
丙 | c(HA)=0.1 mol/L | c(NaOH)=0.1 mol/L | pH=9 |
丁 | pH=2 | pH=12 | pH=b |
请回答:
⑴不考虑其它组的实验结果,单从甲组情况分析,如何用a(混合溶液的pH)来说明HA是强酸还是弱酸 。
⑵c1 (填<、>或=)0.2mol/L。乙组实验中HA和NaOH溶液混合前,HA溶液中c(A-)与NaOH溶液中c(Na+)的关系是 (从下面选项中选择填空)。
A.前者大 B.后者大 C.二者相等 D.无法判断
⑶从丙组实验结果分析,该混合溶液中离子浓度由大到小的顺序是
,其中,c(A-)= mol/L(不能做近似计算,回答准确值,结果不一定要化简)。
⑷丁组实验中,HA和NaOH溶液混合前c(HA) (填<、>或=)c(NaOH),b (填<、>或=)7。
| 实验编号 | c(HA)/mol·L-1 | c(NaOH)/mol·L-1 | 混合溶液的pH |
| 甲 | 0.1 | 0.1 | pH=a |
| 乙 | 0.2 | 0.2 | pH=9 |
| 丙 | c1 | 0.2 | pH=7 |
| 丁 | 0.2 | 0.1 | pH<7 |
1―5CDBCC 6―10BBABA 11―15CBCDC 16―18ADB
19.(6分)(1)+1(1分) (2)CuI (1分) 0.5(2分)
(3)2、5、2、1(2分)
20.(9分)
|