
题目列表(包括答案和解析)
| A | B | D | F | |
| E | 无现象 | 白色沉淀 | 无色气泡 | 白色沉淀 |
| 实验操作 | 实验现象及实验结论 |
取B、F各少量于试管中,分别滴加无色酚酞试液 另取A溶液少量于试管中,滴加无色酚酞试液 取B、F各少量于试管中,分别滴加无色酚酞试液 另取A溶液少量于试管中,滴加无色酚酞试液 |
一支试管中无色酚酞试液变红,另一支不变色. 变红的原溶液为氢氧化钙溶液,不变的原溶液为氯化钙溶液. 若试液变为红色,则原液为氢氧化钠.否则为氯化纳. 一支试管中无色酚酞试液变红,另一支不变色. 变红的原溶液为氢氧化钙溶液,不变的原溶液为氯化钙溶液. 若试液变为红色,则原液为氢氧化钠.否则为氯化纳. |
| 实验步骤和操作 | 实验现象和结论 |
(1)如图所示: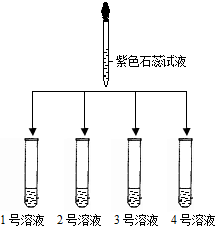 |
①2号溶液由无色变为红色,则2号溶液是 稀盐酸 稀盐酸 ②另三支试管中溶液均由无色变蓝色 |
(2)另取1、3、4、号溶液,分别滴加2号溶液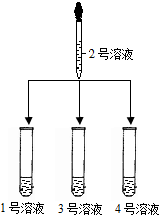 |
①3号溶液中有气泡放出,则3号溶液是 碳酸钠溶液 碳酸钠溶液 ②另二支试管中溶液无明显变化 |
| (3)另取1、4号溶液,分别滴加 碳酸钠溶液 碳酸钠溶液 |
①1号溶液中有白色沉淀析出,则反应的 化学方程式为 Ca(OH)2+Na2CO3=2NaOH+CaCO3↓ Ca(OH)2+Na2CO3=2NaOH+CaCO3↓ ②另一支试管中溶液无明显变化 |
| 实验操作 | 实验现象 | 实验结论 |
| 任取三种溶液 于三支试管中, 分别滴加第四 中溶液 |
一支试管中有气泡放出, 其余二支试管中溶液无明显变化 |
第四种溶液为稀盐酸 |
| 一支试管中有白色沉淀析出, 其余二支试管中溶液无明显变化 |
第四种为碳酸钠溶液 | |
| 三支试管中溶液均无明显变化 | 第四种为氢氧化钠溶液 |
| 实验操作 | 实验现象 | 实验结论 |
(1)如图所示: |
①A、B、C均无明显变化 ②D中有沉淀析出 |
标号为1、2、3、4的 溶液依次为(用化学式 表示): NaOH、Na2CO3、HCl、Ca(OH)2 NaOH、Na2CO3、HCl、Ca(OH)2 或HCl、Ca(OH)2、NaOH、Na2CO3 HCl、Ca(OH)2、NaOH、Na2CO3 |
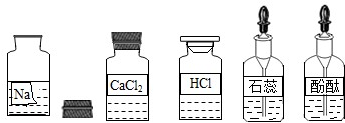
| 实验操作 | 主要实验现象 | 实验结论和解释 |
| 另取样于试管加入过量的CaCl2溶液,静置后,取上层清液,滴入酚酞试液 | ① 产生白色沉淀 产生白色沉淀 ;② 溶液变红色 溶液变红色 ; |
该溶液是变质的NaOH溶液. |
 (2012?房山区二模)小明同学在“金属拓展阅读”活动中了解到:金属钠在常温下与水剧烈反应能生成一种可燃性气体.教师结合小明已有知识设计了如图所示装置进行实验.
(2012?房山区二模)小明同学在“金属拓展阅读”活动中了解到:金属钠在常温下与水剧烈反应能生成一种可燃性气体.教师结合小明已有知识设计了如图所示装置进行实验.| 操作 | 现象及解释 | |
| ① | 打开止水夹a及分液漏斗活塞,待液体充满大试管后,关闭止水夹a及分液漏斗活塞. | 液体分层,钠熔成银白色小球,在液体分层的界面上方跳动,产生大量气泡,下层溶液变成红色,并逐渐被压入B中.金属钠的物理性质(写出一点即可) 银白色、熔点低、密度小于水的密度 银白色、熔点低、密度小于水的密度 . |
| ② | 打开止水夹b,待B中部分溶液进入C中,迅速关闭止水夹b. | 反应的化学方程式为 CO2+2NaOH═Na2CO3+H2O CO2+2NaOH═Na2CO3+H2O |
| ③ | 打开止水夹c. | D中溶液进入C中,产生气泡 D中溶液进入C中,产生气泡 溶液红色消失.反应的化学方程式为 Na2CO3+2HCl=2NaCl+H2O+CO2↑ Na2CO3+2HCl=2NaCl+H2O+CO2↑ . |
| ④ | 将燃着的木条伸到导管尖嘴处,打开止水夹a; 在火焰上方罩一个干冷的烧杯. |
气体燃烧,产生淡蓝色火焰 烧杯内壁有无色液滴生成,A中气体为氢气. |
兴趣小组参观某制碱厂后,获得以下信息并对相关问题进行研究.
【查阅资料】
①粗盐中含有少量可溶性杂质(MgCl2和CaCl2)及不溶性杂质.
②反应原理:NaCl(饱和)+NH3+CO2+H2O=NaHCO3↓+NH4Cl,将分离出的晶体A充分加热,可制得纯碱.
③NH4Cl NH3↑+HCl↑.
NH3↑+HCl↑.
④无水硫酸铜遇水变蓝
⑤部分生产流程如下图所示:

【问题讨论】
(1)①写出加入氢氧化钠溶液所发生反应的化学方程式 ; .
②操作Ⅱ的名称为 .
③反应(1)中加适量盐酸的作用是 .
④反应(2)中为提高产率,所加气体的顺序是 (填字母).
A.先通入二氧化碳再通氨气 B.先通入氨气再通二氧化碳
(2)上述生产流程中不可循环使用的是 (填字母).
A.CO2 B.NH3 C.HCl D.NaOH
【组成探究一】
(3)①晶体A受热分解的化学方程式为 ; .
②设计实验检验纯碱样品中是否混有晶体A请完成下表:

| 选择的装置 | 实验现象 | 实验结论 |
|
|
| 样品不含晶体A |
【组成探究二】
(4)取纯碱样品加水溶解,向其中加入过量稀HNO3,再滴加AgNO3溶液,有白色沉淀.产生沉淀的方程式为 ,确定纯碱样品含有杂质NaCl.
【组成探究三】
(5)同学们为了测定该纯碱样品的纯度,设计了如下实验:

①判断加入BaCl2溶液是否过量的合适方法是 ,观察现象判断.
A.静置混合物X,向上层清液中再滴BaCl2溶液
B.向滤液Y中滴加BaCl2溶液
②判断滤渣是否洗涤干净,可采取向洗涤液中滴加 ,观察现象判断.
A.BaCl2溶液 B.稀H2SO4 C.Na2CO3溶液 D.稀HCl
③根据实验数据,计算样品中碳酸钠的质量分数为 (写出计算过程)
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com