
题目列表(包括答案和解析)
(11分)短周期主族元素A、B、C、D、E原子序数依次增大,A元素单质常温常压下是最轻的气体,B元素所形成化合物种类最多,C的最高价氧化物对应水化物甲与其气态氢化物乙能够化合形成盐丙;D元素的离子半径是同周期元素形成的简单离子中最小的。
(1)已知相关物质之间存在如下变化:
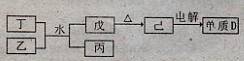
①丁与乙和水反应生成戊和丙的离子方程式为 ,由物质已电解得到单质D的化学方程式为 ;
②0.lmoL/L的丙溶液中所含离子浓度由大到小排列顺序为 。
(2)已知E及其化合物有以下变化:
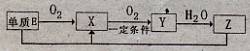
写出单质E与化合物Z在一定条件下反应生成.X和水的化学方程式 。
由A、B、C、D、E5种元素中的.两种元素,可形成既含极性键又含非极性键的18电子的分子,该分子的分子式为____ (任写一个即可)。
(3)C有多种氧化物,其中之一是一种无色气体,在空气中迅速变成红棕色,在一定条件下,2L的该无色气体与0.5L的氧气相混合,若该混合气体被足量的NaOH溶液全吸收后没有气体残留,所生成R的含氧酸盐只有一种,则该含氧酸盐的化学式是 。
(15分)现有A、B、C、D、E、F六种常见化合物,均为强电解质,它们的阳离子有Al3+、NH+4、Na+、Ag+、H+五种,阴离子有Cl-、HCO-3、OH-、NO-3、SO2-4五种,现将它们分别配成0.lmol/L。的溶液,进行如下实验:
①测得A溶液呈碱性,E溶液的pH为1,C溶液的酸性强于E溶液。
②向B溶液中滴入D溶液,出现白色沉淀和无色无味气体,该白色沉淀既能溶于A溶液,又能溶于C溶液;过滤,向滤液中加入A溶液,加热,有刺激性气味气体产生。
③向B溶液中滴加F溶液,产生白色沉淀,加入过量E溶液,沉淀不溶解。
④向E溶液中滴加F溶液,无明显变化。
根据上述实验现象,回答下列问题:
(1)写出下列四种化合物的化学式:
A 、B 、D 、F 。
(2)C溶液是 ,判断依据是____
(3)B、D反应的离子方程式是____ ;
A、B、C、D是短周期元素形成的四种气体单质,其它物质为化合物。H常作为普通锌锰干电池的电解质。有关的转化关系如下图所示(反应条件均已略去)。
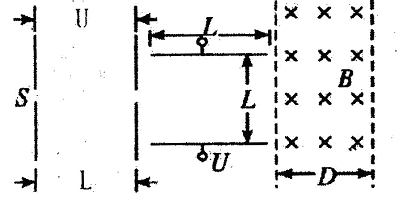
请回答下列问题:
(1)B的结构式为____ ,G的化学式为 。
(2)Y和E在一定条件下可反应生成B和Z,该反应的化学方程式为 。
(3)在体积为0.5L的恒容密闭容器中,充人1.25molB和1.25molD进行如下化学反应:
B(g)+3D(g) 2Y(g),其化学平衡常数K与T的关系如下表所示:
2Y(g),其化学平衡常数K与T的关系如下表所示:
|
T/℃ |
300 |
400 |
|
K |
3.41 |
0.50 |
①若反应在400℃下进行,下列各项中能作为判断该反应达到化学平衡状态依据的是
(填字母)。
A.Y、B、D的物质的量分别为0.50mol、l.0mol、0.50mol
B.v正(B)= 3v 逆(D)
C.容器内压强保持不变
D.混合气体的密度保持不变
②在一定条件下B(g)+3D(g)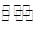 2Y(g)达到平衡状态,时间为t1时改变条件。化学反应速率与反应时间的关系如图。下列说法中正确的是( )
2Y(g)达到平衡状态,时间为t1时改变条件。化学反应速率与反应时间的关系如图。下列说法中正确的是( )
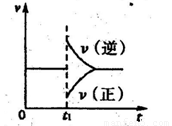
A.维持温度、反应体系体积不变,t1时充入Y(g)
B.维持压强不变,tl时升高反应体系温度
C.维持温度不变,t1时扩大反应体系体积
D.维持温度、压强不变,t1时充入Y(g)
(4)0.lmol·L-1的X溶液和0.2mol·L-1的Y溶液等体积混合后显碱性,则该混合溶液中各离子浓度大小顺序是 .
(5)常温下,0.1mol·L-1的Y溶液中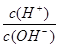 =l×10-8,下列叙述中错误的是 ( )
=l×10-8,下列叙述中错误的是 ( )
A.该溶液的pH=11
B.该溶液中的溶质电离出的阳离子浓度为0.1mol·L-1
C.该溶液中水电离出的c(H+)与c(OH—)乘积为l×10-22
D.pH=l的X溶液V1L与0.1mol·L-1的Y溶液V2L混合,若混合溶液pH =7,则V1<V2
E.将0.1mol·L-1的Y溶液加水稀释100倍后,pH >9
北京奥运会“祥云”火炬燃料是丙烷(C3H8),亚特兰大奥运会火炬燃料是丙烯(C3H6)。
(1)丙烷脱氢可得丙烯。
已知:C3H8(g)= CH4(g)+HC≡CH(g)+H2(g);△H1=156.6 kJ?mol-1
CH3CH=CH2(g) =CH4(g)+HC≡CH(g);△H2=32.4 kJ?mol-1
则相同条件下,反应C3H8(g) =CH3CH=CH2(g)+H2(g)的△H=_____kJ?mol-1
(2)以丙烷为燃料制作新型燃料电池,电池的正极通入O2和CO2,负极通入丙烷,电解质是熔融碳酸盐。电池反应方程式为____________________________________________________;放电时,CO32-移向电池的_____ __(填“正”或“负”)极。
(3)碳氢化合物完全燃烧生成CO2和H2O。常温常压下,空气中的CO2溶于水,达到平衡时,溶液的pH=5.60,c(H2CO3)=1.5×10-5 mol?L-1。若忽略水的电离及H2CO3的第二级电离,则H2CO3![]() HCO3- +H+的平衡常数K1=_____________。(已知:10-5.60=2.5×10-6)
HCO3- +H+的平衡常数K1=_____________。(已知:10-5.60=2.5×10-6)
(4)常温下,0.lmol?L-1NaHCO3溶液的pH大于8,则溶液c(H2CO3)______c(CO32-)(填“>”、“=”或“<”),原因是________________________________________________________(用离子方程式和必要的文字说明)。
现有A、B、C、D、E、F六种常见化合物,均为强电解质,它们的阳离子有Al3+、NH+4、Na+、Ag+、H+五种,阴离子有Cl-、HCO-3、OH-、NO-3、SO2-4五种,现将它们分别配成0.lmol/L。的溶液,进行如下实验:
①测得A溶液呈碱性,E溶液的pH为1,C溶液的酸性强于E溶液。
②向B溶液中滴入D溶液,出现白色沉淀和无色无味气体,该白色沉淀既能溶于A溶液,又能溶于C溶液;过滤,向滤液中加入A溶液,加热,有刺激性气味气体产生。
③向B溶液中滴加F溶液,产生白色沉淀,加入过量E溶液,沉淀不溶解。
④向E溶液中滴加F溶液,无明显变化。
根据上述实验现象,回答下列问题:
(1)写出下列四种化合物的化学式:
A 、B 、D 、F 。
(2)C溶液是 ,判断依据是____
(3)B、D反应的离子方程式是____ ;


湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com