
题目列表(包括答案和解析)
(12分) 为防止碘缺乏病,通常在食盐中加入KIO3。
(1)用淀粉碘化钾溶液和稀硫酸可定性检验出食盐中的IO3-,表示该反应的离子方程
式是________________________________________,
(2)上述反应生成的I2可用四氯化碳检验。向碘的四氯化碳溶液中加入Na2SO3稀溶液
将I2还原,又可以回收四氯化碳。Na2SO3稀溶液与I2反应的离子方程式是 。
(3)已知:I2+2S2O32-=2I-+S4O62-。
某课外活动小组为测定混有MgCl2的食用加碘盐中所含MgCl2、KIO3的含量,按下图所示实验步骤进行实验。
请回答下列问题:
①写出B和C的化学式:B ,C 。
②滴定时,判断滴定达到终点的现象是 。
③KIO3的质量分数是 (列出计算式)。
④使所测MgCl2的质量分数可能偏高的操作是(填写字母)
A 过滤后未洗涤所得沉淀,直接烘干灼烧
B 在敞口容器中用托盘天平称量样品时,操作时间过长
C 沉淀灼烧不彻底
(12分)为防止碘缺乏病,通常在食盐中加入KIO3。
(1)用淀粉碘化钾溶液和稀硫酸可定性检验出食盐中的IO3-,表示该反应的离子方程
式是________________________________________,
(2)上述反应生成的I2可用四氯化碳检验。向碘的四氯化碳溶液中加入Na2SO3稀溶液
将I2还原,又可以回收四氯化碳。Na2SO3稀溶液与I2反应的离子方程式是 。
(3)已知:I2+2S2O32-=2I-+S4O62-。
某课外活动小组为测定混有MgCl2的食用加碘盐中所含MgCl2、KIO3的含量,按下图所示实验步骤进行实验。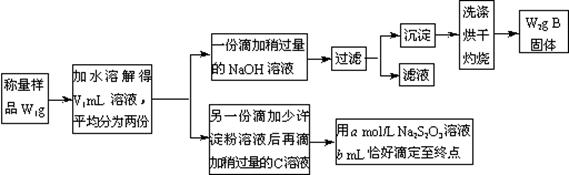
请回答下列问题:
①写出B和C的化学式:B ,C 。
②滴定时,判断滴定达到终点的现象是 。
③KIO3的质量分数是 (列出计算式)。
④使所测MgCl2的质量分数可能偏高的操作是(填写字母)
A 过滤后未洗涤所得沉淀,直接烘干灼烧
B 在敞口容器中用托盘天平称量样品时,操作时间过长
C 沉淀灼烧不彻底
(12分) 为防止碘缺乏病,通常在食盐中加入KIO3。
(1)用淀粉碘化钾溶液和稀硫酸可定性检验出食盐中的IO3-,表示该反应的离子方程
式是________________________________________,
(2)上述反应生成的I2可用四氯化碳检验。向碘的四氯化碳溶液中加入Na2SO3稀溶液
将I2还原,又可以回收四氯化碳。Na2SO3稀溶液与I2反应的离子方程式是 。
(3)已知:I2+2S2O32-=2I-+S4O62-。
某课外活动小组为测定混有MgCl2的食用加碘盐中所含MgCl2、KIO3的含量,按下图所示实验步骤进行实验。

请回答下列问题:
①写出B和C的化学式:B ,C 。
②滴定时,判断滴定达到终点的现象是 。
③KIO3的质量分数是 (列出计算式)。
④使所测MgCl2的质量分数可能偏高的操作是(填写字母)
A 过滤后未洗涤所得沉淀,直接烘干灼烧
B 在敞口容器中用托盘天平称量样品时,操作时间过长
C 沉淀灼烧不彻底

为防止碘缺乏病,通常在食盐中加入KIO3.
(1)用淀粉碘化钾溶液和稀硫酸可定性检验出食盐中的IO3-,表示该反应的离子方程式是________.
(2)上述反应生成的I2可用四氯化碳检验.向碘的四氯化碳溶液中加入Na2SO3稀溶液将I2还原,又可以回收四氯化碳.Na2SO4稀溶液与I2反应的离子方程式是________.
(3)已知:I2+2S2O32-=2I-+S4O62-.
某课外活动小组为测定混有MgCl2的食用加碘盐中所含MgCl2、KIO3的含量,按下图所示实验步骤进行实验.
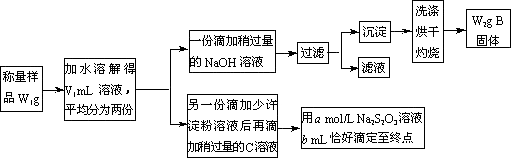
请回答下列问题:
①写出B和C的化学式:B________,C________.
②滴定时,判断滴定达到终点的现象是________.
③KIO3的质量分数是________(列出计算式).
④使所测MgCl2的质量分数可能偏高的操作是(填写字母)________
A过滤后未洗涤所得沉淀,直接烘干灼烧
B在敞口容器中用托盘天平称量样品时,操作时间过长
C沉淀灼烧不彻底
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com