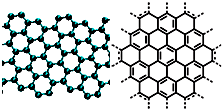
A.美国《科学》杂志评出的2009年十大科学突破之一是石墨烯的研究和应用方面的突破.石墨烯具有原子级的厚度、优异的电学性能、出色的化学稳定性和热力学稳定性.制备石墨烯方法有石墨剥离法、化学气相沉积法等.石墨烯的球棍模型及分子结构示意图如右:
(1)下列有关石墨烯说法正确的是
BD
BD
.
A.石墨烯的结构与金刚石相似
B.石墨烯分子中所有原子可以处于同一平面
C.12g石墨烯含σ键数为NA
D.从石墨剥离得石墨烯需克服石墨层与层之间的分子间作用
(2)化学气相沉积法是获得大量石墨烯的有效方法之一,催化剂为金、铜、钴等金属或合金,含碳源可以是甲烷、乙炔、苯、乙醇或酞菁等中的一种或任意组合.
①钴原子在基态时,核外电子排布式为:
[Ar]3d74s2
[Ar]3d74s2
.
②乙醇沸点比氯乙烷高,主要原因是
乙醇分子间可形成氢键,而氯乙烷分子间无氢键
乙醇分子间可形成氢键,而氯乙烷分子间无氢键
.
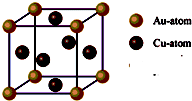
③右图是金与铜形成的金属互化物合金,它的化学式可表示为:
Cu3Au或AuCu3
Cu3Au或AuCu3
.
④含碳源中属于非极性分子的是
a、b、c
a、b、c
(a.甲烷 b.乙炔 c.苯 d.乙醇)
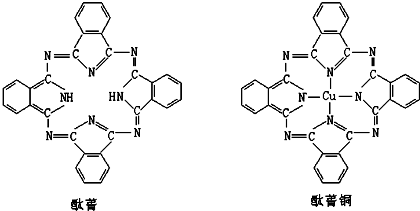
⑤酞菁与酞菁铜染料分子结构如下图,酞菁分子中氮原子采用的杂化方式有:
sp3和sp2
sp3和sp2
;酞菁铜分子中心离子的配位数为:
2
2
.
B.硫酸钾是重要的化工产品,生产方法很多,如曼海姆法、石膏两步转化法等.
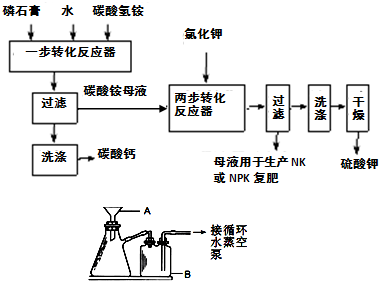
(1)本实验中,采用抽滤方法,图中A、B两仪器名称分别为:
布氏漏斗
布氏漏斗
、
安全瓶
安全瓶
.
(2)在一部转化反应器中发生的反应为:CaSO
4?2H
2O+2NH
4HCO
3=(NH
4)
2SO
4+CaCO
3+CO
2↑+3H
2O,该步反应温度必须低于35℃,其主要目的是
防止NH4HCO3分解
防止NH4HCO3分解
无此空
无此空
.
(3)在两步转化反应器中发生反应的化学方程式为
(NH4)2SO4+2KCl=K2SO4+2NH4Cl
(NH4)2SO4+2KCl=K2SO4+2NH4Cl
无此空
无此空
.
(4)两步转化反应器中用乙二醇代替水作溶剂,其目的是
降低K2SO4溶解度
降低K2SO4溶解度
有利于K2SO4析出,提高产率
有利于K2SO4析出,提高产率
.
(5)磷石膏主要成分为二水硫酸钙(CaSO
4?2H
2O),还含有未分解的磷矿,未洗涤干净的磷酸、氟化钙、铁铝氧化物等,欲检验母液中含Fe
3+,可用亚铁氰化钾溶液检验,该检验反应的离子方程式为:
Fe3++K++[Fe(CN)6]4-=KFe[Fe(CN)6]↓
Fe3++K++[Fe(CN)6]4-=KFe[Fe(CN)6]↓
.
(6)该法优点除K
2SO
4产率高外,再列举一个优点
原料得到充分利用
原料得到充分利用
同时得到副产品化肥等
同时得到副产品化肥等
.





 A.美国《科学》杂志评出的2009年十大科学突破之一是石墨烯的研究和应用方面的突破.石墨烯具有原子级的厚度、优异的电学性能、出色的化学稳定性和热力学稳定性.制备石墨烯方法有石墨剥离法、化学气相沉积法等.石墨烯的球棍模型及分子结构示意图如右:
A.美国《科学》杂志评出的2009年十大科学突破之一是石墨烯的研究和应用方面的突破.石墨烯具有原子级的厚度、优异的电学性能、出色的化学稳定性和热力学稳定性.制备石墨烯方法有石墨剥离法、化学气相沉积法等.石墨烯的球棍模型及分子结构示意图如右:


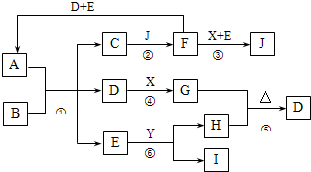 A是由四种短周期元素组成的正盐,X是黄绿色气体,D、F都是无色有刺激性气味的气体;气体I对H2的相对密度是13,且分子中各原子处于同一直线上;D、E分子都是10电子微粒.转化关系如下(部分产物省略):
A是由四种短周期元素组成的正盐,X是黄绿色气体,D、F都是无色有刺激性气味的气体;气体I对H2的相对密度是13,且分子中各原子处于同一直线上;D、E分子都是10电子微粒.转化关系如下(部分产物省略):