
题目列表(包括答案和解析)
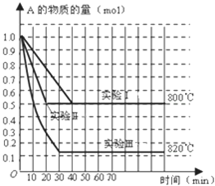 在一密闭容器中发生化学反应:2A(g)?B(g)+C(g);在几种不同条件下进行,其中B、C的起始物质的量为0,反应物A的物质的量随时间变化如图所示,下列说法正确的是( )
在一密闭容器中发生化学反应:2A(g)?B(g)+C(g);在几种不同条件下进行,其中B、C的起始物质的量为0,反应物A的物质的量随时间变化如图所示,下列说法正确的是( )| A、该反应正反应为放热反应 | B、实验Ⅱ和实验Ⅰ比较,实验Ⅱ一定使用了催化剂 | C、在实验Ⅰ中,若容器的体积为0.5L,则从开始到达平衡时间内B的平均反应速率为0.025mol/(L?min) | D、在800℃时,增大压强,若反应重新达平衡时混合气体对氢气的相对密度为64.5,则A的相对分子质量为129 |
在一密闭容器中加入A和B,各物质的物质的量浓度随着反应的进行,如图所示。下列说法不正确的是
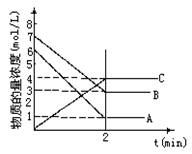
 A.该反应的化学方程式为5A+4B 4C
A.该反应的化学方程式为5A+4B 4C
B.2min时,该反应达到平衡,此时A、B、C的浓度比为5:4:4
C.用B的浓度变化表示0-2min时间内的速率为2mol/(L·min)
D.2min前,正反应速率逐渐减小,逆反应速率逐渐增大,但是正反应速率大于逆反应速率。
在一密闭容器中加入A和B,各物质的物质的量浓度随着反应的进行,如图所示。下列说法不正确的是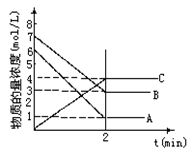
A.该反应的化学方程式为5A+4B 4C
4C
B.2min时,该反应达到平衡,此时A、B、C的浓度比为5:4:4
C.用B的浓度变化表示0-2min时间内的速率为2mol/(L·min)
D.2min前,正反应速率逐渐减小,逆反应速率逐渐增大,但是正反应速率大于逆反应速率。
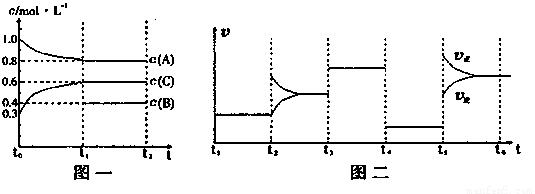
(14分)向一密闭容器中加入2mol A、0.6molC和一定量的B三种气体。一定条件下发生反应,各物质浓度随时间变化如图一所示。图二为t2时刻后改变反应条件,平衡体系中反应速率随时间变化的情况,且四个阶段都各改变一种不同的条件。已知t3-t4阶段为使用催化剂;图一中t0-t1阶段c(B)未画出。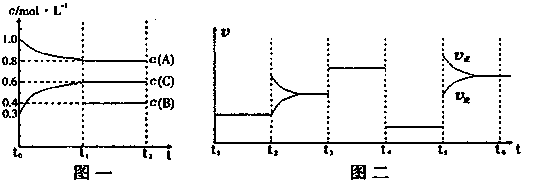
(1)若t1=15min,则t0-t1阶段以C浓度变化表示的反应速率为v(C)= 。
(2)t4-t5阶段改变的条件为 ,B的起始物质的量为 。
该反应方程式可表示为
各阶段平衡时对应的平衡常数如下表所示:
| t1—t2 | t2—t3 | t3—t4 | t4—t5 | t5—t6 |
| K1 | K2 | K3 | K4 | K5 |
(14分)向一密闭容器中加入2mol A、0.6molC和一定量的B三种气体。一定条件下发生反应,各物质浓度随时间变化如图一所示。图二为t2时刻后改变反应条件,平衡体系中反应速率随时间变化的情况,且四个阶段都各改变一种不同的条件。已知t3-t4阶段为使用催化剂;图一中t0-t1阶段c(B)未画出。
(1)若t1=15min,则t0-t1阶段以C浓度变化表示的反应速率为v(C)= 。
(2)t4-t5阶段改变的条件为 ,B的起始物质的量为 。
该反应方程式可表示为
各阶段平衡时对应的平衡常数如下表所示:
|
t1—t2 |
t2—t3 |
t3—t4 |
t4—t5 |
t5—t6 |
|
K1 |
K2 |
K3 |
K4 |
K5 |
则K1= (保留两位小数),K1、K2、K3、K4、K5之间的关系为
K1 K2 K3 K4 K5 (用“>”、“<”或“=”连接)
(3)在相同条件下,若起始时容器中加入a molA、bmolB和cmolC,要达到t1时刻同样的平衡(各物质的百分含量相同),a、b、c要满足的条件为 。
(含a,b,c的代数式表示)
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com