
题目列表(包括答案和解析)
(1)小明在做“研究温度对反应速率的影响”实验时,他取了两只试管,均加入4mL 0.01mol/L的KMnO4酸性溶液和2mL 0.1mol/L H2C2O4(乙二酸)溶液,振荡,A试管置于热水中,B试管置于凉水中,记录溶液褪色所需的时间。
①需要用 来酸化KMnO4溶液,褪色所需时间tA tB(填“>”、“=”或“<”).
②写出该反应的离子方程式 .
(2)实验室有瓶混有泥沙的乙二酸样品,小明利用这个反应的原理来测定其含量,具体操作为:
①配制250mL溶液:准确称量5.0g乙二酸样品,配成250mL溶液。
②滴定:准确量取25.00mL所配溶液于锥形瓶中,加少量酸酸化,将0.1000mol?L﹣1KMnO4溶液装入
(填“酸式”或“碱式”)滴定管,进行滴定操作。在实验中发现,刚滴下少量KMnO4溶液时,溶液迅速变成紫红色。将锥形瓶摇动一段时间后,紫红色慢慢消失;再继续滴加时,紫红色就很快褪色了。请解释原因: 。当 ,证明达到滴定终点.
③计算:再重复上述操作2次,记录实验数据如下.
| 序号 | 滴定前读数(mL) | 滴定后读数(mL) |
| 1 | 0.00 | 20.10 |
| 2 | 1.00 | 20.90 |
| 3 | 0.00 | 21.10 |
(1)小明在做“研究温度对反应速率的影响”实验时,他取了两只试管,均加入4mL 0.01mol/L的KMnO4酸性溶液和2mL 0.1mol/L H2C2O4(乙二酸)溶液,振荡,A试管置于热水中,B试管置于凉水中,记录溶液褪色所需的时间。
①需要用 来酸化KMnO4溶液,褪色所需时间tA tB(填“>”、“=”或“<”)。
②写出该反应的离子方程式 。
(2)实验室有瓶混有泥沙的乙二酸样品,小明利用这个反应的原理来测定其含量,具体操作为:
①配制250 mL溶液:准确称量5.0g乙二酸样品,配成250mL溶液。
②滴定:准确量取25.00 mL所配溶液于锥形瓶中,加少量酸酸化,将0.1000 mol·L-1 KMnO4溶液装入 (填“酸式”或“碱式”)滴定管,进行滴定操作。
在实验中发现,刚滴下少量KMnO4溶液时,溶液迅速变成紫红色。将锥形瓶摇动一段时间后,紫红色慢慢消失;再继续滴加时,紫红色就很快褪色了。请解释原因:
。当____
,证明达到滴定终点。
③计算:再重复上述操作2次,记录实验数据如下。
| 序号 | 滴定前读数(mL) | 滴定后读数(mL) |
| 1 | 0.00 | 20.10 |
| 2 | 1.00 | 20.90 |
| 3 | 1.10 | 21.10 |
| 序号 | 滴定前读数(mL) | 滴定后读数(mL) |
| 1 | 0.00 | 20.10 |
| 2 | 1.00 | 20.90 |
| 3 | 0.00 | 21.10 |
Ⅰ.研究NO2、SO2、CO等大气污染气体的处理具有重要意义。
(1)已知:2SO2(g) + O2(g)![]() 2SO3(g) ΔH= —Q1 kJ·mol-1
2SO3(g) ΔH= —Q1 kJ·mol-1
2NO(g) + O2(g)![]() 2NO2(g) ΔH= —Q2kJ·mol-1
2NO2(g) ΔH= —Q2kJ·mol-1
则反应NO2(g) + SO2(g)![]() SO3(g) + NO(g) 的ΔH= kJ·mol-1。
SO3(g) + NO(g) 的ΔH= kJ·mol-1。
 (2)一定条件下,将NO2与SO2以体积比1:2置于密闭容器中发生
(2)一定条件下,将NO2与SO2以体积比1:2置于密闭容器中发生
上述反应, 当测得上述反应平衡时NO2与NO体积比为1:3,
则平衡常数K= 。
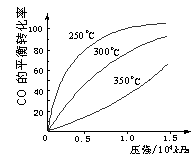
(3)CO可用于合成甲醇,反应方程式为:
CO(g)+2H2(g)![]() CH3OH(g)。CO在不同温度下的
CH3OH(g)。CO在不同温度下的
平衡转化率与压强的关系如下图所示。该反应ΔH 0
(填“>”或“ <”)。
Ⅱ.已知草酸是一种二元弱酸,草酸氢钠(NaHC2O4)溶液显酸性。
(1)用离子方程式解释Na2C2O4溶液显碱性的原因 ;
(2)常温下,比较0.1 mol·L-1NaHC2O4溶液中各种离子浓度的大小关系 ;
Ⅲ.某课外活动小组为了探究的BaSO4溶解度,分别将足量BaSO4放入:a. 5ml 水;b. 40 ml 0.2 mol·L-1的Ba(OH)2溶液;c. 20ml 0.5 mol·L-1的Na2SO4溶液;d. 40ml 0.1 mol·L-1的H2SO4溶液中,溶解至饱和。
(1)以上各溶液中,的浓度由大到小的顺序为 ;
A.b>a>c>d B.b>a>d>c C.a>d>c>b D.a>b>d>c
(2)某同学取同样的溶液b和溶液d直接混合,则混合溶液的pH值为 (设混合溶液的体积为混合前两溶液的体积之和)。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com