
题目列表(包括答案和解析)
 硝酸与金属反应时,浓度越稀还原产物价态越低.现用一定量的铝粉与镁粉组成的混合物与100ml硝酸钾溶液与硫酸组成的混合溶液充分反应,反应过程中无任何气体放出,相反应后的溶液中逐滴加入4.00mol/L的NaOH溶液,加入的溶液体积与与产生的沉淀质量的关系如图所示.回答下列问题:
硝酸与金属反应时,浓度越稀还原产物价态越低.现用一定量的铝粉与镁粉组成的混合物与100ml硝酸钾溶液与硫酸组成的混合溶液充分反应,反应过程中无任何气体放出,相反应后的溶液中逐滴加入4.00mol/L的NaOH溶液,加入的溶液体积与与产生的沉淀质量的关系如图所示.回答下列问题: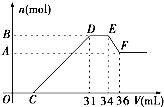 硝酸发生氧化还原反应的时候,一般硝酸越稀,对应的还原产物中氮的化合价越低.现有一定量的铝、铁合金与一定量稀HNO3充分反应,反应过程中无任何气体放出.在反应结束后的溶液中,逐滴加入4mol/L NaOH溶液,所加NaOH溶液的体积(V)与产生沉淀的物质的量(n)关系如图所示.下列说法中不正确的是( )
硝酸发生氧化还原反应的时候,一般硝酸越稀,对应的还原产物中氮的化合价越低.现有一定量的铝、铁合金与一定量稀HNO3充分反应,反应过程中无任何气体放出.在反应结束后的溶液中,逐滴加入4mol/L NaOH溶液,所加NaOH溶液的体积(V)与产生沉淀的物质的量(n)关系如图所示.下列说法中不正确的是( )| A、合金与硝酸反应时硝酸过量 | B、合金中铝的物质的量为0.008mol | C、合金中金属的物质的量共为0.032mol | D、无法求出C点的值 |
(1)一定条件下硝酸铵受热分解的未配平化学反应方程式为:NH4NO3—HNO3+N2+H2O在反应中被氧化与被还原的氮原子数之比为_________。
(2)某硝酸盐受热分解的产物为不含氮元素的固体物质和NO2、O2气体,若产生NO2和O2的物质的量之比为8∶1,则金属元素的价态在反应过程中_________(填“升高”“降低”“不变”)。若该硝酸盐的化学式表示为M(NO3)2,则其受热分解的化学方程式为______________________________。
(3)2 mol Cu(NO3)2和AgNO3混合物,加热使其分解,得到NO2、O2两种气体和CuO、Ag二种固体,将产生的NO2、O2混合气体经水充分吸收后,剩余气体是____________________,其物质的量(mol)范围是_______________________________________。
 硝酸与金属反应时,还原产物可能是NO2、NO、N2O、N2或NH
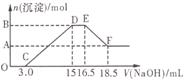
硝酸与金属反应时,还原产物可能是NO2、NO、N2O、N2或NH![]() 中的一种或几种。现有一定量的Al粉和Fe粉的混合物与100mL稀硝酸充分反应,反应过程中无任何气体放出。在反应结束后的溶液中逐滴加入4mol/L的NaOH溶液,加入NaOH溶液的体积与产生沉淀的物质的量的关系如图,则下列说法中不正确的是
中的一种或几种。现有一定量的Al粉和Fe粉的混合物与100mL稀硝酸充分反应,反应过程中无任何气体放出。在反应结束后的溶液中逐滴加入4mol/L的NaOH溶液,加入NaOH溶液的体积与产生沉淀的物质的量的关系如图,则下列说法中不正确的是
A.与HNO3反应后,Fe元素的化合价为+3
B.D→E段反应的离子方程式为:NH![]() +OH-=NH3·H2O
+OH-=NH3·H2O
C.纵坐标A点数值为0.008
D.纵坐标B点数值为0.012
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com