
题目列表(包括答案和解析)

- 4 |
| 1000.00 mL |
| 20.00 mL |
| 10 g×20.00%-1.68 g |
| 10 g×20.00% |
| 1000.00 mL |
| 20.00 mL |
| 10 g×20.00%-1.68 g |
| 10 g×20.00% |
(9分)某工厂废水中含游离态氯,通过下列实验测定其浓度。
①取水样10.00 mL于锥形瓶中,加入10.00 mL KI溶液(足量),滴入指示剂2—3滴。
②取一滴定管依次用自来水、蒸馏水洗净,然后注入0.01 mol·L-1Na2S2O3溶液(显碱性),调整液面,记下读数。
③将锥形瓶置于滴定管下进行滴定,发生的反应为:I2+2Na2S2O3====2NaI+Na2S4O6。
试完成下列问题:
(1)步骤①加入的指示剂是____________________。
(2)步骤②应使用__________式滴定管。
(3)步骤③当待测液由___________色变为__________色且不再变化即达终点,若耗去Na2S2O3溶液20.00 mL,则废水中Cl2的物质的量浓度为____________________。
(4)Cl2的实际浓度比所测浓度应_____________(“偏大”“偏小”或“相等”),造成误差的原因是_______________________________。(若认为没有误差,此问不答)
(9分)某工厂废水中含游离态氯,通过下列实验测定其浓度。
①取水样10.00 mL于锥形瓶中,加入10.00 mL KI溶液(足量),滴入指示剂2—3滴。
②取一滴定管依次用自来水、蒸馏水洗净,然后注入0.01 mol·L-1Na2S2O3溶液(显碱性),调整液面,记下读数。
③将锥形瓶置于滴定管下进行滴定,发生的反应为:I2+2Na2S2O3====2NaI+Na2S4O6。
试完成下列问题:
(1)步骤①加入的指示剂是____________________。
(2)步骤②应使用__________式滴定管。
(3)步骤③当待测液由___________色变为__________色且不再变化即达终点,若耗去Na2S2O3溶液20.00 mL,则废水中Cl2的物质的量浓度为____________________。
(4)Cl2的实际浓度比所测浓度应_____________(“偏大”“偏小”或“相等”),造成误差的原因是_______________________________。(若认为没有误差,此问不答)
实验室采用MgCl2、AlCl3的混合溶液与过量氨水反应制备MgAl2O4二主要流程如下:
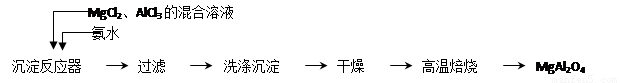
(1)制备MgAl2O4过程中,高温焙烧时发生反应的化学方程式 。
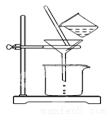
(2)如图所示,过滤操作中的一处错误是 。
判断流程中沉淀是否洗净所用的试剂是 。高温焙烧时,用于盛放固体的仪器名称是 。
(3)在25℃下,向浓度均为0.01 mol・L-1的MgCl2和AlCl3混合溶液中逐滴加入氨水,先生成__________沉淀(填化学式),生成该沉淀的离子方程式______________(已知25℃时Ksp[Mg(OH)2]=1.8×10-11,Ksp[Al(OH)3]=3×10 -34。)
(4)无水AlCl3(183℃升华)遇潮湿空气即产生大量白雾,实验室可用下列装置制备。
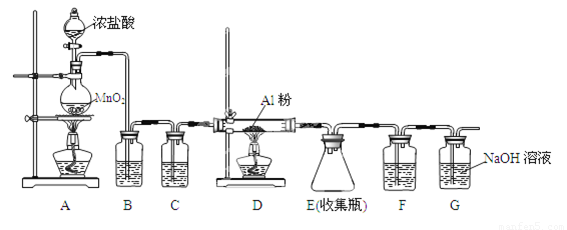
装置B中盛放饱和NaCl溶液,该装置的主要作用是 ;F中试剂的作用是 ;用一件仪器装填适当试剂后也可起到F和G的作用,所装填的试剂为 _。
(5)将Mg、Cu组成的1.96g混合物投入过量稀硝酸中,充分反应后,固体完全溶解时收集到还原产物NO气体0.896L(标准状况),向反应后的溶液中加入2mol/L的NaOH溶液80mL时金属离子恰好完全沉淀。则形成沉淀的质量为 g。
(6分)有一硝酸盐晶体,分子式为M(NO3)x·nH2O,经测定其摩尔质量为
242g / mol。取1.21 g此晶体溶于水,配制成100 mL溶液。 将其置于电解池中用惰性材料为电极进行电解。经测定,当有0.01 mol电子通过电极时,溶液中全部金属离子即在阴极上析出,电极增重0.32 g。计算:(写出计算过程)
(1) 1.21 g此盐晶体的物质的量是多少?x值是多少?
(2) 求M的相对原子质量和n值。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com