A、B、C、D、E是中学化学常见的5种化合物,其中A、B是氧化物.单质X、Y是生活中常见的金属,相关物质间的转化关系如图所示(部分反应物与产物已略去);
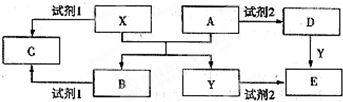
(1)若试剂1与试剂2不属于同类物质,则X与试剂1反应的离子方程式是
2Al+2H2O+2OH-=2AlO2-+3H2↑
2Al+2H2O+2OH-=2AlO2-+3H2↑
.
(2)若试剂1和试剂2相同,且E溶液加热蒸干并灼烧后可得到A,则A的化学式是
Fe2O3
Fe2O3
.
①检验物质D的溶液中金属离子的实验操作是
取少量溶液于试管中,滴加几滴KSCN溶液,溶液变红色,则证明原溶液中含有Fe3+
取少量溶液于试管中,滴加几滴KSCN溶液,溶液变红色,则证明原溶液中含有Fe3+
.
②将物质C溶于水,其溶液呈
酸性
酸性
(填“酸性”、“中性”或“碱性”),原因用离子方程来表示为
Al3++3H2OAl(OH)3+3H+
Al3++3H2OAl(OH)3+3H+
.
(3)若E溶液隔绝空气加热、蒸干后,可得到该溶液的溶质,工业上用E、稀硫酸和NaNO
2为原料来制备高效净水剂Y(OH)SO
4,反应中有NO生成,该反应的化学方程式是
2FeSO4+2NaNO2+H2SO4=2Fe(OH)SO4+Na2SO4+2NO↑
2FeSO4+2NaNO2+H2SO4=2Fe(OH)SO4+Na2SO4+2NO↑
.

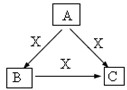 A、B、C、X是中学化学常见物质,均由短周期元素组成,转化关系如图.请针对以下三种不同情况回答:
A、B、C、X是中学化学常见物质,均由短周期元素组成,转化关系如图.请针对以下三种不同情况回答:


