
题目列表(包括答案和解析)
亚氯酸钠(NaClO2)是一种重要的含氯消毒剂,主要用于水的消毒以及砂糖、油脂的漂白与杀菌。以下是过氧化氢法生产亚氯酸钠的工艺流程图:
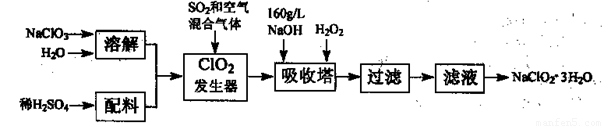
已知:①NaClO2的溶解度随温度升高而增大,适当条件下可结晶析出NaClO2—3H2O。
②纯ClO2易分解爆炸,一般用稀有气体或空气稀释到10%以下安全。
(1)发生器中鼓入空气的作用可能是 。
(2)吸收塔内发生反应的化学方程式为 。
吸收塔内的温度不宜过高,否则会发生反应,其方程式为: 。
(3)在碱性溶液中NaClO2比较稳定,所以吸收塔中应维持NaOH稍过量,判断NaOH是否过量的简单实验方法是__ __。
(4)ClO2和氯气均能将电镀废水中的CN—氧化为无毒物质,自身被还原为Cl—,处理含CN一相同量的电镀废水所需氯气的物质的量是ClO2的 倍。
亚氯酸钠(NaClO2)是一种重要的含氯消毒剂,主要用于水的消毒以及砂糖、油脂的漂白与杀菌。以下是过氧化氢法生产亚氯酸钠的工艺流程图: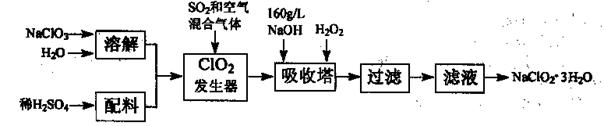
已知:①NaClO2的溶解度随温度升高而增大,适当条件下可结晶析出NaClO2—3H2O。
②纯ClO2易分解爆炸,一般用稀有气体或空气稀释到10%以下安全。
(1)发生器中鼓入空气的作用可能是 。
(2)吸收塔内发生反应的化学方程式为 。
吸收塔内的温度不宜过高,否则会发生反应,其方程式为: 。
(3)在碱性溶液中NaClO2比较稳定,所以吸收塔中应维持NaOH稍过量,判断NaOH是否过量的简单实验方法是__ __。
(4)ClO2和氯气均能将电镀废水中的CN—氧化为无毒物质,自身被还原为Cl—,处理含CN一相同量的电镀废水所需氯气的物质的量是ClO2的 倍。
草酸是一种重要的试剂。下面是利用草酸探究浓度对反应速率影响的实验。
(1)为证明浓度对反应速率的影响,曾有教科书《化学反应原理》设计了如下实验:取两支试管,各加入4mL0.01mol·L-1的KMnO4酸性溶液,分别向其中加入0.1 mol·L-1、0.2 mol·L-1 H2C2O4溶液2mL,记录溶液褪色所需时间。
实验中发生反应的离子方程式为: ;
预期现象是:
①溶液的颜色由 色变为 色,
②其中加入 mol·L-1H2C2O4的那支试管中的溶液先变色。
然而实验结果并不尽如人意。实验过程颜色复杂,且褪色先缓慢,后逐渐加快;最大的问题是草酸浓度大,反应速率却更慢。
本实验能否作为课堂实验研究浓度对化学反应速率的影响?适宜的条件是怎样的?某校一研究小组对此进行了探究。下面是他们的实验报告的一部分:
表1 试验安排及结果
|
实验 编号 |
A(KMnO4溶液浓度/mol·L-1) |
B(草酸溶液浓度/mol·L-1) |
C(硫酸溶液浓度/mol·L-1) |
褪色时间/s |
|
1 |
3 |
3 |
1 |
336 |
|
2 |
1 |
2 |
3 |
82 |
|
3 |
3 |
1 |
3 |
76 |
|
4 |
1 |
3 |
2 |
133 |
|
5 |
2 |
3 |
3 |
102 |
|
6 |
3 |
2 |
2 |
156 |
|
7 |
2 |
2 |
1 |
300 |
|
8 |
2 |
1 |
2 |
115 |
|
9 |
1 |
1 |
1 |
200 |
应用SPSS16.0对正交试验结果进行方差分析,结果如下表
表2 各因素水平的数据处理结果
|
|
A(KMnO4溶液) |
B(草酸溶液) |
C(硫酸溶液) |
||||||
|
浓度/mol·L-1 |
0.005 |
0.010 |
0.015 |
0.1 |
0.5 |
0.9 |
6 |
12 |
18 |
|
平均褪色时间/s |
138.3 |
172.3 |
189.3 |
130.3 |
179.3 |
190.3 |
278.7 |
134.7 |
86.7 |
(2)由表2可知,三因素中, 的浓度(选填“A、B或C”,下空同)对反应速率影响显著,而 的浓度对反应速率的影响不显著。
(3)由表2可知,当高锰酸钾浓度为 mol·L-1、草酸浓度为 mol·L-1时,反应最快。即因素A、B的较适宜实验条件得以确定。
根据以上实验结果,该小组同学继续探究硫酸的浓度是怎样影响本反应速率的,测得如下实验结果:
表3 不同硫酸浓度下的褪色时间
|
c(H2SO4)/mol·L-1 |
18 |
16 |
14 |
12 |
10 |
8 |
6 |
|
褪色时间/s |
67 |
83 |
90 |
103 |
129 |
146 |
200 |
(4)根据课堂实验的合适时间,可选溶液的褪色时间约为1分钟和2分钟的两份溶液,即此时硫酸的浓度为 mol·L-1和 mol·L-1,这也有利于观察这两个反应速率的差异。
结论:草酸与酸性高锰酸钾溶液的反应,可作为课堂实验探究浓度对反应速率的影响。
草酸是一种重要的试剂。下面是利用草酸探究浓度对反应速率影响的实验。
(1)为证明浓度对反应速率的影响,曾有教科书《化学反应原理》设计了如下实验:取两支试管,各加入4mL0.01mol·L-1的KMnO4酸性溶液,分别向其中加入0.1 mol·L-1、0.2 mol·L-1 H2C2O4溶液2mL,记录溶液褪色所需时间。
实验中发生反应的离子方程式为: ;
预期现象是:
①溶液的颜色由 色变为 色,
②其中加入 mol·L-1H2C2O4的那支试管中的溶液先变色。
然而实验结果并不尽如人意。实验过程颜色复杂,且褪色先缓慢,后逐渐加快;最大的问题是草酸浓度大,反应速率却更慢。
本实验能否作为课堂实验研究浓度对化学反应速率的影响?适宜的条件是怎样的?某校一研究小组对此进行了探究。下面是他们的实验报告的一部分:
表1 试验安排及结果
| 实验 编号 | A(KMnO4溶液浓度/mol·L-1) | B(草酸溶液浓度/mol·L-1) | C(硫酸溶液浓度/mol·L-1) | 褪色时间/s |
| 1 | 3 | 3 | 1 | 336 |
| 2 | 1 | 2 | 3 | 82 |
| 3 | 3 | 1 | 3 | 76 |
| 4 | 1 | 3 | 2 | 133 |
| 5 | 2 | 3 | 3 | 102 |
| 6 | 3 | 2 | 2 | 156 |
| 7 | 2 | 2 | 1 | 300 |
| 8 | 2 | 1 | 2 | 115 |
| 9 | 1 | 1 | 1 | 200 |
| | A(KMnO4溶液) | B(草酸溶液) | C(硫酸溶液) | ||||||
| 浓度/mol·L-1 | 0.005 | 0.010 | 0.015 | 0.1 | 0.5 | 0.9 | 6 | 12 | 18 |
| 平均褪色时间/s | 138.3 | 172.3 | 189.3 | 130.3 | 179.3 | 190.3 | 278.7 | 134.7 | 86.7 |
| c(H2SO4)/mol·L-1 | 18 | 16 | 14 | 12 | 10 | 8 | 6 |
| 褪色时间/s | 67 | 83 | 90 | 103 | 129 | 146 | 200 |
世界环保联盟将全面禁止在自来水中加氯,取而代之的是安全高效的杀菌消毒剂ClO2.
ClO2是一种黄绿色,有刺激性气味的气体,熔点:-59℃,沸点:11.0℃,它可以看作是亚氯酸(HClO2)和氯酸(HClO3)的混合酸酐,少量的ClO2可用饱和草酸(H2C2O4)溶液与KClO3粉末在60℃时反应制得.甲、乙、丙三位同学分别设计了如图三套制备装置:(△代表热源,铁架台石棉网略)

(1)从甲、乙、丙三套装置中选出合理部分(按气流从左向右的方向)组装成一套较为完善的实验装置(填所选部分的编号)________.
(2)为了能使反应在适宜的条件下进行,在组装的装置中还应添加某一仪器,该仪器的名称是________.
(3)组装后的装置中的尾气吸收剂与尾气(含ClO2等气体)能发生反应,生成的主要物质(除水外)是________、________和________(写化学式).
(4)文献报道,等质量时,ClO2的消毒效果是Cl2的2.63倍,由此可判断ClO2的最终还原产物是________(用离子符号或化学式表示),推断依据是________(填计算式).
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com