
题目列表(包括答案和解析)
离子方程式:![]() +2H+=CO2↑+H2O表示的意义是
+2H+=CO2↑+H2O表示的意义是
[ ]
A.一切碳酸盐与一切酸之间的反应
B.碳酸盐与盐酸之间的反应
C.可溶性碳酸盐与强酸之间的反应
D.酸式碳酸盐与强酸之间的反应
 2PbSO4(s) +2H2O(l)。电解一段时间后,向c极和d极附近分别滴加酚酞试剂,c极附近溶液变红,下列说法正确的是____________(填写序号)。
2PbSO4(s) +2H2O(l)。电解一段时间后,向c极和d极附近分别滴加酚酞试剂,c极附近溶液变红,下列说法正确的是____________(填写序号)。 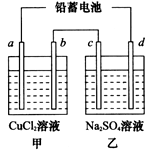
 H++A2-。
H++A2-。  CH3OH(g) △H=-90.8kJ/mol
CH3OH(g) △H=-90.8kJ/mol  CH3OCH3(g)+H2O(g) △H=-23.5kJ/mol
CH3OCH3(g)+H2O(g) △H=-23.5kJ/mol  CO2(g)+H2(g) △H=-41.3kJ/mol
CO2(g)+H2(g) △H=-41.3kJ/mol  2SO3(g)。在一定温度下,将0.23molSO2和0.11molO2通入容积为1L的密闭容器中发生反应,达到平衡后得到0.12molSO3,则反应的平衡常数K=__________。若温度不变,再通入0.50molO2后重新达到平衡,则SO3的体积分数将__________(填“增大”“不变”或“减小”)。
2SO3(g)。在一定温度下,将0.23molSO2和0.11molO2通入容积为1L的密闭容器中发生反应,达到平衡后得到0.12molSO3,则反应的平衡常数K=__________。若温度不变,再通入0.50molO2后重新达到平衡,则SO3的体积分数将__________(填“增大”“不变”或“减小”)。 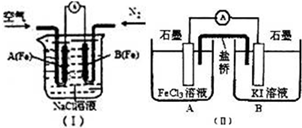 研究铁及铁的化合物的性质具有重要意义.
研究铁及铁的化合物的性质具有重要意义. “节能减排”,减少全球温室气体排放,意义十分重大。二氧化碳的捕捉与封存是实现温室气体减排的重要途径之一,科学家利用 溶液喷淋“捕捉”空气中的
溶液喷淋“捕捉”空气中的 。
。
(1)使用过量 溶液吸收
溶液吸收 ,反应的离子方程式为________;若含有3molNaOH的溶液“捕捉”了22.4L
,反应的离子方程式为________;若含有3molNaOH的溶液“捕捉”了22.4L 气体(标准状况),则所得溶液中钠与碳元素的物料守恒关系式为__________(用离子浓度的关系式表示)。
气体(标准状况),则所得溶液中钠与碳元素的物料守恒关系式为__________(用离子浓度的关系式表示)。
(2)①以 和
和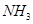 为原料可合成化肥尿素[
为原料可合成化肥尿素[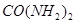 ]。已知:
]。已知:
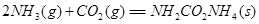
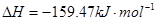 ①
①

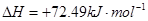 ②
②
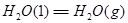
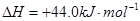 ③
③
试写出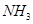 和
和 合成尿素和液态水的热化学方程式__________。
合成尿素和液态水的热化学方程式__________。
② 通过反应可转化为
通过反应可转化为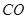 ,在催化剂作用下CO和
,在催化剂作用下CO和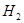 反应生成甲醇:
反应生成甲醇: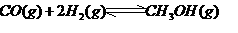 某容积可变的密闭容器中充有10molCO与20mol
某容积可变的密闭容器中充有10molCO与20mol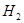 ,CO的平衡转化率(a)与温度、压强的关系如下图所示。
,CO的平衡转化率(a)与温度、压强的关系如下图所示。
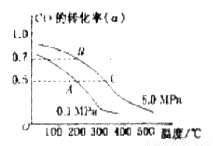
A.若A点表示在某时刻达到的平衡状态,此时容器的容积为VL,则该温度下的平衡常数K=__________;平衡状态B点时容器的容积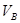 _______VL。(填“大于”、“小于”或“等于”)
_______VL。(填“大于”、“小于”或“等于”)
B.若A、C两点都表示达到的平衡状态,则自反应开始到达平衡状态所需的时间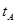 _______
_______ (填“>”、“<”或“=”)
(填“>”、“<”或“=”)
C.在不改变反应物用量的情况下,为提高CO的转化率可采取的措施是________(写出一种即可)。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com