
题目列表(包括答案和解析)
(方程式2分,其余每空1分,共11分)
(1)空气污染指数是根据空气中 、 、 等污染物的浓度计算出来的数值。
(2)糖类可分为 、 和 。蔗糖、麦芽糖和乳糖属 于 。
于 。
(3)下表是我国部分城市空气质量周报,阅读并回答下列问题:
| 城市 | 污染 指数 | 首 要 要污染物 | 空气质量级别 | 城市 | 污染 指数 | 首要 污染物 | 空气质量级别 |
| 北京 | 92 | TS P P | II | 济南 | 76 | TSP | II |
| 天津 | 82 | TSP | II | 武汉 | 83 | NOx | II |
| 哈尔滨 | 96 | TSP | II | 重庆 | 98 | SOx | II |
| 上海 | 74 | NOx |  II II | 长沙 | 61 | TSP | II |
| 注:TSP——空气中的飘尘 | |||||||
 ;为减少城市酸雨的产生,可采取以下措施中的
;为减少城市酸雨的产生,可采取以下措施中的  。
。
| ||
某反应中反应物与生成物有:FeCl2、FeCl3、CuCl2、Cu。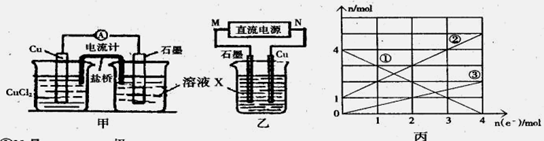
(1)将上述反应设计成的原电池如图甲所示,请回答下列问题:
①图中X溶液是 ;
②Cu电极上发生的电极反应式为 ;
③原电池工作时,盐桥中的 离子(填“K+”或“Cl—”)不断进入X溶液中。
(2)将上述反应设计成的电解池如图乙所示,乙烧杯中金属阳离子的物质的量与电子转移的物质的量的变化关系如图丙,请回答下列问题:
①M是 极;
②图丙中的②线是_______________离子的变化。
③当电子转移为2mol时,向乙烧杯中加入 L 5mol·L-1NaOH溶液才能使所有的金属阳离子沉淀完全。
(3)铁的重要化合物高铁酸钠(Na2FeO4)是一种新型饮用水消毒剂,具有很多优点。
①高铁酸钠生产方法之一是电解法,其原理为Fe+2NaOH+2H2O
 Na2FeO4+3H2↑,则电解时阳极的电极反应式是 。
Na2FeO4+3H2↑,则电解时阳极的电极反应式是 。
②高铁酸钠生产方法之二是在强碱性介质中用NaClO氧化Fe(OH)3生成高铁酸钠、氯化钠和水,该反应的离子方程式为 。
③Na2FeO4能消毒、净水的原因 。
某反应中反应物与生成物有:FeCl2、FeCl3、CuCl2、Cu。
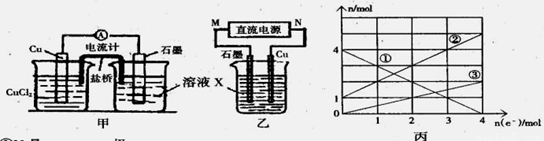
(1)将上述反应设计成的原电池如图甲所示,请回答下列问题:
①图中X溶液是 ;
②Cu电极上发生的电极反应式为 ;
③原电池工作时,盐桥中的 离子(填“K+”或“Cl—”)不断进入X溶液中。
(2)将上述反应设计成的电解池如图乙所示,乙烧杯中金属阳离子的物质的量与电子转移的物质的量的变化关系如图丙,请回答下列问题:
①M是 极;
②图丙中的②线是_______________离子的变化。
③当电子转移为2mol时,向乙烧杯中加入 L 5mol·L-1NaOH溶液才能使所有的金属阳离子沉淀完全。
(3)铁的重要化合物高铁酸钠(Na2FeO4)是一种新型饮用水消毒剂,具有很多优点。
①高铁酸钠生产方法之一是电解法,其原理为Fe+2NaOH+2H2O
 Na2FeO4+3H2↑,则电解时阳极的电极反应式是
。
Na2FeO4+3H2↑,则电解时阳极的电极反应式是
。
②高铁酸钠生产方法之二是在强碱性介质中用NaClO氧化Fe(OH)3生成高铁酸钠、氯化钠和水,该反应的离子方程式为 。
③Na2FeO4能消毒、净水的原因 。



| ||
| ||
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com