
题目列表(包括答案和解析)
以
BaS为原料制备Ba(OH)2·8H2O的过程是:BaS与HCl反应,所得溶液在70℃~90℃时与过量NaOH溶液作用,除杂,冷却后得到Ba(OH)2·8H2O晶体.据最新报道,生产效率高、成本低的Ba(OH)2·8H2O晶体的新方法是使BaS与CuO反应……(1)写出新方法的反应方程式________.
(2)该反应的反应物CuO是不溶物,为什么该反应还能进行?________.
(3)简述新方法生产效率高、成本低的原因:________.
以BaS为原料制备Ba(OH)2·8H2O的过程是:BaS与HCl反应,所得溶液在70~90℃时与过量NaOH溶液作用,除杂,冷却后得到Ba(OH)2·8H2O晶体.据最新报道,生产效率高、成本低的Ba(OH)2·8H2O晶体的新方法是使BaS与CuO反应……
(1)新方法的反应方程式为________.
(2)该反应反应物CuO是不溶物,为什么该反应还能进行:________.
(3)简述新方法生产效率高、成本低的原因.
根据初中化学知识,硫酸铜溶液与氢氧化钠溶液反应可得到蓝色沉淀,进一步将沉淀加热可生成黑色物质.小明做了这个实验:他在试管里倒入2 mL硫酸铜溶液,再加入一定量的氢氧化钠溶液,结果得到的沉淀并不是蓝色,而是浅绿色的;将此浊液加热直至沸腾,观察不到有黑色CuO产生的现象.这是为什么呢?小明通过查找资料得知,该浅绿色沉淀物可能是溶解度极小的碱式硫酸铜,其化学式为Cu4(OH)6SO4.
(1)请帮小明写出生成浅绿色沉淀的有关反应的化学方程式________.
(2)请帮小明设计一个实验,证明该浅绿色沉淀中含有硫酸根离子________.
微生物对人类有着各种各样的用途,现在生物工程学家利用微生物从矿石中提取金属。铜是一种很有价值的金属,可以从铜矿中提取。微生物法是采用某些细菌能用空气中的氧气氧化硫化铜矿石,把不溶性的硫化铜转化成可溶的硫酸铜。利用细菌提取铜的生产过程:在已有细菌存在的岩石.矿石堆中,喷洒酸水以促进细菌生长;在它们的生长过程中,氧化而成的硫酸铜形成低浓度的溶液流到矿石堆的底部,再从这种溶液中提取金属铜。水循环使用,再回到矿石堆中。在美国,10%的铜是用这种方法生产的。
试回答下列问题:
(1)细菌把硫化铜氧化为硫酸铜的过程中起了什么作用: 。
(2)从硫酸铜溶液中提取铜,简便而经济的方法是 ;相应的化学方程式为: 。
(3)普通生产铜的方法是在空气中燃烧硫化铜(产物中有一种气态氧化物)。试比较两种方法的优缺点。
。
(4)用一定量的铁与足量的稀H2SO4及足量的CuO制成单质铜,有人设计以下两种方案:①Fe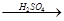 H2
H2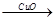 Cu ②CuO
Cu ②CuO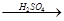 CuSO4
CuSO4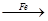 Cu
Cu
若按实验原则进行操作,则两者制得单质铜的量的比较中,正确的是 ( )
| A.①多 | B.②多 | C.相等 | D.无法判断 |
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com