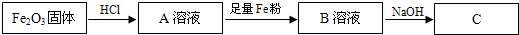《实验化学》茶是我国人民喜爱的饮品,其中含有多种有益于人体健康的成分,据测定茶叶中含有450种以上的有机成分与15种以上的元素.某化学研究小组欲探究茶叶中钙元素的含量(已知茶叶中的铝、铁元素对钙离子的测定有影响),设计了探究实验方案如下:
步骤1:称取250g干燥的茶叶,置于通风橱中,充分灼烧使茶叶灰化,再用研钵磨细后移入烧杯中,然后将100mL 2mol?L
-1盐酸加入灰中搅拌、过滤、洗涤.
步骤2:向步骤1所得滤液中逐滴加入稀氢氧化钠溶液,调节溶液的pH为6~7左右,使铝、铁的氢氧化物完全沉淀,再加热煮沸30min,加入7.95g无水碳酸钠,充分搅拌,待沉淀完全后,过滤,洗涤,得到滤液和沉淀.
步骤3:将步骤2所得的滤液稀释至500mL,取其中的25.00mL溶液以酚酞作指示剂,用0.1000mol?L
-1的HCl标准溶液滴定,终点时消耗盐酸的体积为25.00mL,计算结果.
请回答下列问题:
(1)步骤 1中,使茶叶灰化需要的仪器有三角架、泥三角、酒精喷灯、
.
(2)步骤2中,改用试剂
来调节pH将更为方便;判断沉淀已经洗涤干净的方法是
.
(3)步骤3中,被滴定的25mL滤液中 CO
32-的物质的量为
mol,
(4)原茶叶中钙离子的质量分数为
.若碳酸钠试剂不纯,且所含杂质不与Ca
2+反应,则测得的钙离子的质量分数将
.
A.偏小 B.偏大 C.无影响 D.偏小或偏大或无影响.


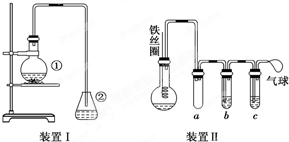
 为探究铁和铁的化合物的一些化学性质,某学生实验小组设计了以下实验.
为探究铁和铁的化合物的一些化学性质,某学生实验小组设计了以下实验.