
题目列表(包括答案和解析)
下列热化学方程式或说法正确的是 ( )
A.甲烷的燃烧热为△H=-890kJ·mol-1,则
B.500℃、30MPa下,将0.5mol N2和1.5molH2置于密闭的容器中充分反应生成NH3(g),放热19.3kJ,其热化学方程式为:N2(g)+3H2(g) 2NH3(g) △H=-38.6kJ∙mol-1
2NH3(g) △H=-38.6kJ∙mol-1
C.已知:H2(g)+F2(g) = 2HF(g) △H= —270 kJ/mol,则1 mol氢气与1 mol氟气反应生成2 mol液态氟化氢放出的热量小于270 kJ
D.在C中相同条件下,2 mol HF气体的能量小于1 mol氢气与1 mol氟气的能量总和
下列热化学方程式或说法正确的是 ( )
| A.甲烷的燃烧热为△H=-890kJ·mol-1,则 |
B.500℃、30MPa下,将0.5mol N2和1.5molH2置于密闭的容器中充分反应生成NH3(g),放热19.3kJ,其热化学方程式为:N2(g)+3H2(g) 2NH3(g)△H=-38.6kJ?mol-1 2NH3(g)△H=-38.6kJ?mol-1 |
| C.已知:H2(g)+F2(g) = 2HF(g)△H=" —270" kJ/mol,则1 mol氢气与1 mol氟气反应生成2 mol液态氟化氢放出的热量小于270 kJ |
| D.在C中相同条件下,2 mol HF气体的能量小于1 mol氢气与1 mol氟气的能量总和 |
高中阶段常用化学反应方程式
CH4、H2、C都是优质的能源物质,它们燃烧的热化学方程式为:
①CH4(g)+2O2(g)=CO2(g)+2H2O(l) ΔH=-890.3 kJ·mol-1,
②2H2(g)+O2(g)=2H2O(l) ΔH=-571.6 kJ·mol-1,
③C(s)+O2(g)=CO2(g) ΔH=-393.5 kJ·mol-1。
(1)在深海中存在一种甲烷细菌,它们依靠酶使甲烷与O2作用产生的能量存活,甲烷细菌使1 mol甲烷生成CO2气体与液态水,放出的能量________(填“>”“<”或“=”)890.3 kJ。
(2)甲烷与CO2可用于合成合成气(主要成分是一氧化碳和氢气):CH4+CO2=2CO+2H2,1 g CH4完全反应可释放15.46 kJ的热量,则:
①下图能表示该反应过程中能量变化的是________(填字母)。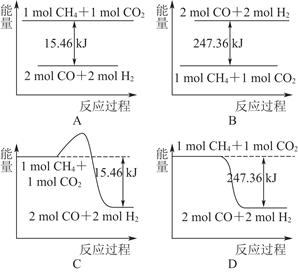
②若将物质的量均为1 mol的CH4与CO2充入某恒容密闭容器中,体系放出的热量随着时间的变化如图所示,则CH4的转化率为________。
(3)C(s)与H2(g)不反应,所以C(s)+2H2(g)=CH4(g)的反应热无法直接测量,但通过上述反应可求出,C(s)+2H2(g)=CH4(g)的反应热ΔH=________。
(4)目前对于上述三种物质的研究是燃料研究的重点,下列关于上述三种物质的研究方向中可行的是________(填字母)。
| A.寻找优质催化剂,使CO2与H2O反应生成CH4与O2,并放出热量 |
| B.寻找优质催化剂,在常温常压下使CO2分解生成碳与O2 |
| C.寻找优质催化剂,利用太阳能使大气中的CO2与海底开采的CH4合成合成气(CO、H2) |
| D.将固态碳合成为C60,以C60作为燃料 |
|
氢气(H2)、一氧化碳(CO)、辛烷(C8H18)和甲烷(CH4)的热化学方程式分别为: H2(g)+1/2O2(g) CO(g)+1/2O2(g) C8H18(1)+25/2O2(g) CH4(g)+2O2(g) 相同质量的H2、CO、C8H18和CH4完全燃烧时,放出热量最少的是 | |
A. |
H2(g) |
B. |
CO(g) |
C. |
C8H18(1) |
D. |
CH4(g) |
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com